Autorki: Sylwia Kowalczyk, Kamila Miazga
1. Wstęp
Nazwa „antybiotyk” pochodzi od słowa antybioza i powstała ze złożenia greckich słów „anti”- przeciw i „biotikos”- związany z życiem. Po raz pierwszy terminu antybiotyk użył Waksman w 1942 roku w celu określenia substancji chemicznej, wytwarzanej przez drobnoustroje i mającej zdolność zabijania lub hamowania wzrostu innych mikroorganizmów. W 1947 roku Benedict i Langlykke zmodyfikowali powyższą definicję, uzupełniając ją o cechę oligodynamiczności, a więc aktywności w bardzo dużych rozcieńczeniach.Gdy okazało się, że antybiotyki są produkowane przez wszystkie organizmy żywe, włoski uczony Marscherp sformułował nową definicję i mianem antybiotyku określił: „substancję samoistnie wytwarzaną przez żyjące organizmy (albo otrzymaną syntetycznie, o strukturze analogicznej do struktury związku naturalnego), działającą w niskich stężeniach w sposób wybiórczy na mikroorganizmy, zabijającą je wskutek aktywności antymetabolicznej”. Obecnie zaś pod pojęciem antybiotyku rozumiemy substancję naturalną, wytwarzaną przez organizmy żywe – głównie drobnoustroje, pochodną chemiczną takiej substancji lub jej analog otrzymany syntetycznie, która, już w małych stężeniach, działa wybiórczo na strukturę, procesy biologiczne lub namnażanie komórek.
2. Pochodzenie (biogeneza) antybiotyków
Naturalne – wszystkie podstawowe grupy organizmów żywych, zasiedlających naszą planetę, produkują związki o działaniu antybiotycznym. Antybiotyki są wytwarzane przez:
– promieniowce,
– bakterie,
– grzyby (podstawczaki, workowce i grzyby konidialne),
– porosty i nieliczne glony,
– rośliny wyższe,
– organizmy zwierzęce.
Półsyntetyczne – naturalne substancje antybiotyczne, poddane modyfikacjom chemicznym.
Syntetyczne – związki chemiczne, które naśladują działanie naturalnych antybiotyków.
3. Antybiotyk a chemioterapeutyk. Klasyfikacja związków o działaniu antybiotycznym
Różnice między antybiotykiem a chemioterapeutykiem oraz ich klasyfikację prezentuje Rysunek 1.
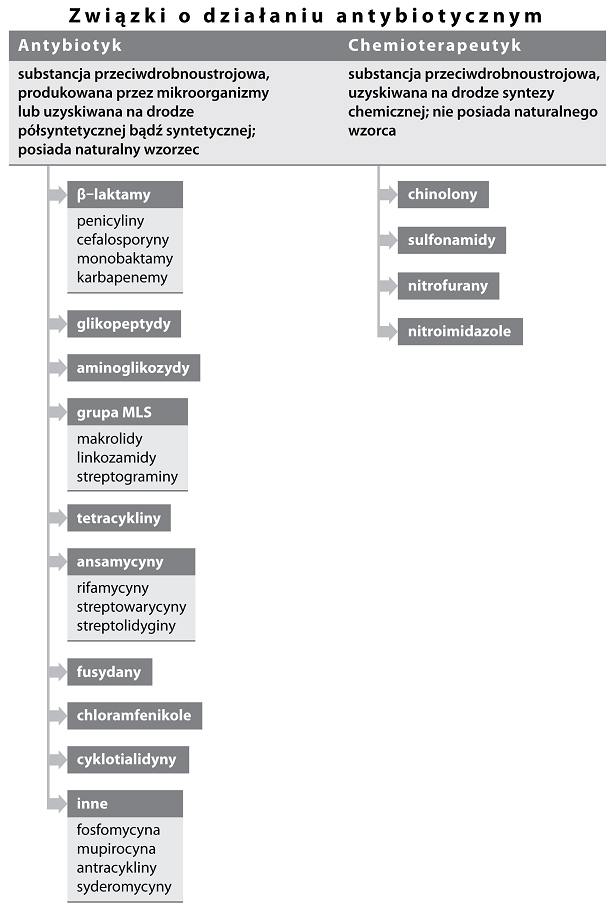
Rys. 1. Różnice między antybiotykiem a chemioterapeutykiem oraz ich klasyfikacja.
4. Tolerowanie (tolerancja) antybiotyków
Zjawisko polegające na tym, że komórki bakteryjne utrzymują się przy życiu, pomimo obecności antybiotyku w środowisku. Wyróżniamy:
– tolerancję fenotypową – uwarunkowaną stanem fizjologicznym bakterii. Antybiotyki działają bakteriobójczo na bakterie jedynie wtedy, gdy komórki dzielą się i rosną. Natomiast ograniczenie wzrostu i podziałów powoduje, iż te same bakterie ”tolerują” dany antybiotyk;
– tolerancję genotypową – uwarunkowaną specyficzną mutacją. Mutanty tolerancyjne posiadają niezmienioną wartość minimalnego stężenia hamującego (MIC) antybiotyku ale przy podwyższonym minimalnym stężeniu bakteriobójczym (MBC).
5. Parametry charakteryzujące relacje między antybiotykiem a drobnoustrojem
MIC (ang. minimal inhibitory concentration) – minimalne stężenie hamujące; jest to najmniejsze stężenie antybiotyku, które w określonych warunkach powoduje całkowite zahamowanie wzrostu badanego drobnoustroju w podłożu;
MBC (ang. minimal bactericidal concentration) – minimalne stężenie bakteriobójcze przy którym liczba żywych bakterii maleje poniżej 0,1% (MBC jest zawsze większe lub równe MIC);
MAC (ang. minimal antibiotic concentration) – minimalne stężenie antybiotyku wywołujące zmiany morfologiczne komórek bakteryjnych (np. zmiany kształtu komórek).
6. Efekt działania antybiotyków
Antybiotyki mogą działać na komórkę bakteryjną:
– bakteriostatycznie – pozbawiają bakterie zdolności do replikacji i podziału komórkowego, nie zabijając ich. Po usunięciu antybiotyku bakterie odzyskują zdolność do wzrostu. Przy tego typu działaniu antybiotyk nie jest silnie związany z komórką, dlatego może być z niej usunięty, umożliwiając procesom komórkowym powrót do pierwotnej aktywności (np. antybiotyki β- laktamowe, aminoglikozydy);
– bakteriobójczo – zabijają bakterie w określonym stężeniu i czasie. Efekt bakteriobójczy związany jest z silnym i nieodwracalnym wiązaniem się ze strukturą komórki, co w efekcie prowadzi do hamowania funkcji życiowych bakterii (cykloseryna, wiomycyna). Niektóre antybiotyki, w stężeniu terapeutycznym, mogą działać bakteriostatycznie zaś w wyższym stężeniu bakteriobójczo (np. tetracykliny, makrolity niepolienowe).
7. Mechanizmy działania antybiotyków
Ze względu na różnorodność budowy i właściwości antybiotyki mogą wpływać na procesy życiowe komórki bakteryjnej. Główne cele ich działania prezentuje rys. 2.
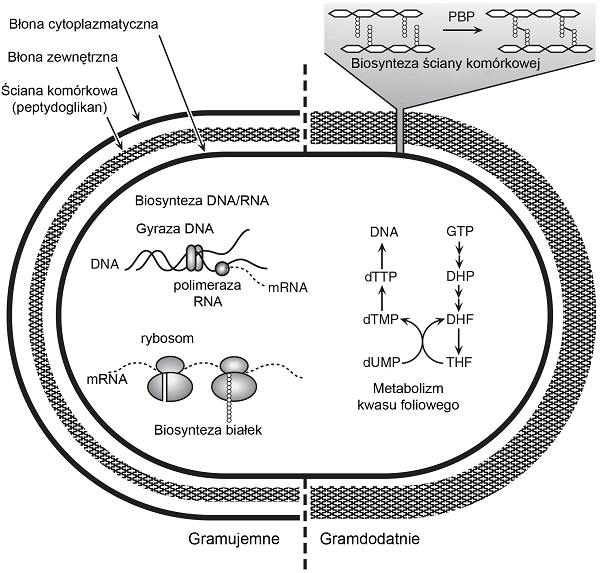
Rys. 2. Główne cele działania antybiotyków.
Zakłócanie funkcji błony cytoplazmatycznej
Na funkcjonowanie błony cytoplazmatycznej bakterii oddziaływują liczne antybiotyki peptydowe. Antybiotyki działają na błonę w dwojaki sposób:
Tworzą dodatkowe pory (kanały) w błonie przez które wyciekają drobnocząsteczkowe składniki cytosolu, co z kolei prowadzi do śmierci komórki. Przy małych stężeniach, antybiotyki peptydowe wiążą się równolegle z powierzchnią dwuwarstwowej błony cytoplazmatycznej, przy większych stężeniach- ustawiają się prostopadle do błony (wnikają do niej).
Sposoby tworzenia porów w błonie bakterii wyjaśniają trzy modele:
– model „beczułki” – w którym helisy antybiotyków peptydowych tworzą w błonie wiązkę przypominającą ustawienie klepek w beczce. W tego typu porze regiony hydrofobowe ustawiają się wzdłuż lipidów błony zaś regiony hydrofilowe stanowią wewnętrzną część pora;
– model „dywanowy” – dochodzi tu do elektrostatycznego przyciągania antybiotyku peptydowego przez anionowe, fosfolipidowe główki błony cytoplazmatycznej. W efekcie powierzchnia pokrywa się dywanem antybiotyku. Po osiągnięciu krytycznego stężenia antybiotyk zaburza strukturę membrany i niczym detergent powoduje wytworzenie miceli;
– model „pora toroidalnego” – helisy peptydu wnikają do wnętrza błony biologicznej, a w miejscu ich penetracji dochodzi do zagięcia monowarstw fosfolipidowych. Światło powstałych porów wyścielone jest zarówno białkami jak i główkami fosfolipidowymi.
Pełnią funkcje specyficznych nośników jonów (antybiotyki jonoforowe) – ułatwiają przechodzenie jonów nieorganicznych przez błonę cytoplazmatyczną bakterii. Antybiotyki, wykazujące powinowactwo do określonego kationu metalu, wiążą go za pomocą wiązań wodorowych, tworząc pewnego rodzaju „klatkę”. Ze względu na hydrofobowy charakter zewnętrznej powierzchni „klatki” powstały kompleks jon- antybiotyk jest rozpuszczalny w membranie i może dyfundować przez błonę biologiczną na zewnątrz komórki, gdzie jest uwalniany. Jest to działanie specyficzne, w odróżnieniu od mechanicznego uszkodzenia błony, powodującego transport w obu kierunkach. Jonofory silniej działają na bakterie gramdodatnie, ponieważ błona zewnętrzna bakterii gramujemnych stanowi skuteczną barierę dla dużych cząsteczek antybiotyków peptydowych.
– Tworzenie kompleksów z błonami i przesuwanie się wraz z nimi w poprzek błony (jonofory ruchome) – antybiotyk (np. walinomycyna) wykazuje powinowactwo do jonów potasu. Jon, zamknięty wewnątrz struktury cylindrycznej, traci swoją warstwę hydratacyjną i zamiast w niej, tkwi w hydrofobowej cząsteczce antybiotyku. W efekcie transport takiego jonu do wnętrza komórki jest ułatwiony. Po oddaniu jonu, uprotonowany antybiotyk jonoforowy powraca na zewnętrzną powierzchnię błony. Utrata jonów potasu prowadzi do zakłócenia procesów energetycznych i kończy się śmiercią komórki bakteryjnej;
– Wbudowywanie się do błony biologicznej i tworzenie sztucznych kanałów błonowych (jonofory nieruchome) – zlokalizowane są w poprzek błon komórkowych lub liposomowych. Zewnętrzna powierzchnia antybiotyku ma charakter hydrofobowy zaś wewnętrzna, tworząca kanał, jest hydrofilowa. Sztuczne kanały błonowe pozwalają na transport jonów rozpuszczalnych w wodzie oraz małych cząsteczek. Czynnikiem ograniczającym jest wielkość cząsteczki a także jej kształt i ładunek. Przykładem działanie gramicydyny A. W błonie cytoplazmatycznej cząsteczka tego antybiotyku zwija się w pusty wewnątrz cylinder. Utworzony kanał ułatwia transport jonom potasowym, blokuje natomiast przechodzenie anionów i kationów wielowartościowych. Efektem jest śmierć komórki, spowodowana zmianami w wewnątrzkomórkowym stężeniu kationów oraz utraty jonów potasu.
Bezpośrednie zahamowanie procesu replikacji
Kowalencyjne wiązanie z DNA – antybiotyki tworzą mostki łączące przeciwległe miejsca dwóch łańcuchów DNA, co z kolei blokuje ruch widełek replikacyjnych (np. mitomycyna i pokrewne antybiotyki).
Hamowanie działania bakteryjnej polimerazy DNA – antybiotyki selektywnie hamują działanie polimerazy DNAIII (głównego enzymu odpowiedzialnego za replikację u bakterii). Przypuszcza się, że antybiotyki reagują z aminokwasem aromatycznym, zlokalizowanym blisko centrum aktywnego enzymu (np. antybiotyki należące do grupy hydroksyfenyloazopirymidyn, ulegające redukcji do odpowiednich związków hydrazonowych, we wrażliwych na antybiotyk komórkach bakteryjnych).
Tworzenie nieprawidłowych par – poprzez połączenie antybiotyku z zasadą azotową w łańcuchu DNA (np. hydroksyfenyloazouracylu z cytozyną, czy hydroksyfenyloazoizocytozyny z tyminą).
Uszkodzenie matrycy DNA. Niektóre antybiotyki ulegają w komórce bakteryjnej redukcji do związków o większej aktywności niż związek wyjściowy. Powstałe związki, bądź uwalniane przez nie wolne rodniki, powodują wytwarzanie przerw w szkieletach cukrowo- fosforanowych DNA. Taki mechanizm działania wykazują nitrofurany.
Blokowanie biosyntezy prekursorów kwasów nukleinowych
Hamowanie syntezy prawidłowych nukleotydów purynowych – strukturalne analogi aminokwasu, które blokują centrum aktywne enzymu, biorącego udział w przenoszeniu atomów azotu na akceptor nukleotydowy w reakcji biosyntezy pierścienia purynowego. Aminokwasy takie jak kwas glutaminowy, glutamina i kwas asparaginowy mogą być bezpośrednimi donorami grupy aminowej w reakcjach biosyntezy związków azotowych (puryn), np. hadacyna i alanozyna- analogi kwasu asparaginowego, azaseryna- analog glutaminy.
Hamowanie syntezy prawidłowych nukleotydów pirymidynowych – antybiotyk, będący analogiem nukleozydu, hamuje jego fosforylację (np. showdomycyna).
Hamowanie działania określonych enzymów (blokowanie aktywności topoizomeraz – w szczególności topoizomerazy II czyli gyrazy)
Działanie na podjednostkę GyrA
Gyraza rozdziela potomne i złączone ze sobą, koliste cząsteczki DNA bakterii, powstałe w wyniku replikacji. Rozcina jedną kolistą cząsteczkę DNA, umożliwiając drugiej kolistej cząsteczce przejście przez powstałe rozcięcie. Zahamowanie aktywności tego enzymu jest spowodowane reakcją antybiotyku z podjednostką A gyrazy. Taki mechanizm działania posiadają np. chinoliny i kwas nalidyksowy. Antybiotyki te stabilizują przerwę w obydwu niciach DNA (powodują zahamowanie ligacji już przeciętego DNA).
Działanie na podjednostkę GyrB
Gyraza likwiduje napięcia torsyjne powstałe wskutek rozwijania podwójnej helisy i ruchu widełek replikacyjnych. Rozplatanie DNA w widełkach replikacyjnych zamkniętej, kolistej cząsteczki prowadzi do powstania dodatnich superzwojów. Dodatkowe superskręty mogą być częściowo kompensowane przez naturalną, ujemną superhelikalność kolistego DNA, jednakże nie umożliwia ona dalszego przemieszczania się widełek replikacyjnych. Dodatnie superskręty muszą być zatem systematycznie usuwane poprzez wprowadzanie ujemnych superskrętów przez gyrazę. Przyłączenie antybiotyku do podjednostki B gyrazy powoduje, że enzym ten traci aktywność ATP- azową (niezbędną do jego aktywności). Uniemożliwiają tym samym hydrolizę ATP, konieczną do wprowadzania ujemnego superzwinięcia w DNA. Prowadzi to do zbyt dużego skręcania matrycy, powstającego przed widełkami replikacyjnymi, na skutek miejscowej denaturacji DNA. W ten sposób synteza DNA bakteryjnego zostaje zahamowana.Taki mechanizm działania posiadają nowobiocyna i kumermycyna.
Hamowanie syntezy RNA
Hamowanie aktywności polimerazy RNA
Antybiotyki, wiążąc się z podjednostką β bakteryjnej polimerazy RNA, blokują inicjację transkrypcji. Uniemożliwiają wytworzenie pierwszego wiązania fosfodiestrowego w łańcuchu RNA. Inhibitorami transkrypcji są ryfamycyny i jej półsyntetyczne pochodne np. rifampicyna. Innym antybiotykiem blokującym syntezę RNA jest streptolidygina, która, wiążąc się z podjednostką β polimerazy, hamuje elongację transkrypcji.
Blokowanie matrycy DNA
Antybiotyk wiąże się ściśle i specyficznie do dwuniciowego DNA, co uniemożliwia wykorzystanie go jako matrycy w syntezie RNA, np. aktynomycyna D.
Hamowanie syntezy białka poprzez blokowanie funkcji rybosomalnych
Antybiotyki oddziaływujące na podjednostkę 30S rybosomu
– Wiążą się trwale do małej podjednostki rybosomu. Efektem jest zablokowanie wiązania aminoacylo-tRNA do miejsca akceptorowego A w kompleksie mRNA-rybosom, np. tetracykliny.
– Wiążą się do białka w podjednostce 30S rybosomu. Małe stężenie antybiotyku prowadzi do błędnego odczytywania kodu mRNA i wbudowywania niewłaściwych aminokwasów (powstają białka niefunkcjonalne), większe stężenie- całkowicie hamuje translację. Przykładem antybiotyki aminoglikozydowe czy streptomycyna.
Antybiotyki oddziaływujące na podjednostkę 50S rybosomu
– Wiążą się w sposób odwracalny do białka w podjednostce 50S rybosomu.
Blokują miejsce wiązania peptydylo-tRNA (miejsce P rybosomu) a tym samym blokują translokację i oddysocjowanie niepełnego polipeptydu, np. erytromycyna.
– Wiążą się w pobliżu centrum aktywnego enzymu peptydylotransferazy.
Hamują aktywność tego enzymu i uniemożliwia prawidłowe wiązanie aminoacylo- tRNA do miejsca A na rybosomie. W efekcie tworzenie wiązania peptydowego jest zahamowane. Taki mechanizm działania wykazuje np. chloramfenikol czy linkozamidy.
– Stanowią strukturalne analogi aminoacylo-tRNA. Grupa aminowa antybiotyku reaguje z wolna grupą karboksylową peptydylo-tRNA, tworząc połączenie peptydylo-antybiotyk. Połączenie to nie może być rozerwane, przez co utworzenie kolejnego wiązania peptydowego staje się niemożliwe i synteza białka zostaje zahamowana. Dochodzi do przedwczesnego uwolnienia syntetyzowanego fragmentu peptydowego z przyłączoną cząsteczką antybiotyku, np. puromycyna.
– Hamują wczesne etapy syntezy białka. Antybiotyki inaktywują centrum aktywne peptydylotransferazy nie dopuszczając do reakcji transpeptydacji. Przykładem: streptograminy grupy A.
– Hamują późne etapy syntezy białka. Antybiotyki zaburzają właściwe ustawienie peptydylo-tRNA w miejscu P rybosomu, co prowadzi do zahamowania tworzenia wiązań peptydowych i uwolnienia niekompletnego łańcucha polipeptydowego. Przykładem są streptograminy grupy B.
Antybiotyki nie wiążące się do rybosomu
Mechanizm ich działania opiera się na hamowaniu aktywności syntetazy izoleucylo- tRNA, co w konsekwencji blokuje syntezę bakteryjnego tRNA i hamowania syntezy białka, np. mupirocyna.
Hamowanie syntezy ściany komórkowej bakterii
Inhibitory I etapu syntezy mureiny
D-cykloseryna – jest analogiem strukturalnym L-alaniny. Hamuje aktywność racematy alaninowej i ligazy D-alanylo-D-alaninowej, a więc enzymów odpowiedzialnych za prawidłowe wytworzenie łańcuchów peptydowych mureiny. D-cykloseryna powoduje, że powstający muropeptyd jest pozbawiony końcowej D-alaniny.
Inhibitory II etapu syntezy mureiny
Bacytracyna – wiąże się z pirofosforanem baktoprenolu, pozostającym w błonie cytoplazmatycznej, po przeniesieniu disacharydopentapeptydu (prekursora, służącego do wydłużania łańcucha cukrowego peptydoglikanu), na zewnętrzną stronę błony. Bacytracyna hamuje defosforylację pirofosforanu baktoprenolu (w postaci C55- PP) do monofosforanu baktoprenolu (w postaci C55-P), a tym samym uniemożliwia przeniesienie kolejnej jednostki prekursora mureiny.
Inhibitory III etapu syntezy mureiny
Wankomycyna – hamuje proces transglikozylacji i transpeptydacji mureiny,tylko u bakterii gramdodatnich. Wankomycyna wiąże się z końcową D-alanylo-D-alaniną prekursora (UDP-N-acetylomuramylopentapeptydu) oraz z wolnymi grupami D-alanylo-D-alaniny w już istniejącej mureinie. Powstały w ten sposób kompleks hamuje wydłużanie łańcucha cukrowego mureiny (transglikozylację) oraz tworzenie poprzecznych wiązań peptydowych między peptydami prekursora a peptydami już istniejącego peptydoglikanu.
Penicylina – przypomina substrat dla enzymu, odpowiedzialnego za poprzeczne usieciowanie ściany komórkowej bakterii. Antybiotyk ten wiąże się odwracalnie z centrum aktywnym enzymu, lokując się w sąsiedztwie reszty serynowej. W efekcie dochodzi do wytworzenia wiązania kowalencyjnego między enzymem a penicyliną i zablokowania centrum aktywnego. Tworzy się wówczas niestabilna ściana komórkowa i dzielące się bakterie obumierają.
8. Ogólna charakterystyka antybiotykooporności
Definicje antybiotykooporności:
– „Właściwość bakterii, decydująca o jej zdolności do inaktywacji lub utrudniania penetracji antybiotyku do komórek; albo mechanizm, który blokuje hamujący lub zabójczy efekt działania antybiotyku”;
– „Zdolność mikroorganizmu do przeciwstawiania się antybiotykowi”;
– „Oporność mikrobiologiczna w której oporne mikroorganizmy to te, które przejawiają jakąkolwiek formę oporności lub genu warunkującego oporność;
albo oporność kliniczna w której bakteria klasyfikowana jest jako podatna lub oporna zależnie od tego czy wywoływana przez nią infekcja reaguje na terapię czy nie”.
Wyróżniamy:
Oporność wrodzoną (naturalną) – jest to oporność charakterystyczna dla danego szczepu, gatunku czy całej rodziny bakterii. Nie jest przenoszona w wyniku horyzontalnego transferu genów. Nie istnieje niebezpieczeństwo przeniesienia tej oporności do bakterii patogennych.
Oporność nabytą – pojawia się u bakterii w wyniku presji selekcyjnej, spowodowanej stosowaniem antybiotyków. Początkowo wrażliwe bakterie stają się oporne w wyniku zmian w ich genomie. Zmiany te mogą być spowodowane:
– mutacjami w genomie bakterii, a więc zmianami losowymi, najczęściej błędami w sekwencji nukleotydowej DNA;
– nabyciem genu lub zespołu genów, determinujących oporność od innych bakterii opornych, np. przez koniugację. Taka zmiana jest trwała a w konsekwencji dziedziczna. Może być rozprzestrzeniana w wyniku HTG.
Stwierdzono, że oporność bakterii na antybiotyki jest częściej spowodowana nabywaniem nowych genów niż mutacją.
Oporność krzyżowa, występująca w sytuacji gdy oporność na jeden antybiotyk (grupę antybiotyków) oznacza oporność na inne antybiotyki z danej grupy lub o podobnym mechanizmie działania.
Zmienność genetyczna
Zasadniczą przyczyną występowania wysokiej częstości oporności na antybiotyki u bakterii jest zmienność genetyczna. Najważniejszą rolę odgrywają mechanizmy horyzontalnego przekazywania genów oporności, odpowiedzialne za efektywne rozprzestrzenianie się markerów oporności wśród bakterii.
Horyzontalny (lateralny) transfer genów- HTG (ang. horizontal gene transfer) jest procesem, pozwalającym na nabywanie wielu genów (w tym genów oporności), podczas jednego procesu rekombinacyjnego. Stanowi siłę napędową ewolucji bakteryjnej. HTG związany jest z przenoszeniem informacji genetycznej pomiędzy komórkami bakteryjnymi, należącymi do tego samego gatunku, jak również do różnych gatunków a nawet rodzajów. W HTG uczestniczy pokaźna pula mobilnej informacji genetycznej.
Zjawisko horyzontalnego transferu genów odbywa się na drodze: koniugacji, transdukcji, transformacji.
Głównym mechanizmem horyzontalnego transferu genów u bakterii jest koniugacja. Jest to spowodowane obecnością genów oporności na ruchomych elementach genetycznych (plazmidach czy transpozonach koniugacyjnych). Z kolei ich obecność jest warunkiem koniecznym aby komórka bakteryjna mogła zostać dawcą materiału genetycznego w procesie koniugacji. Poza tym koniugacja umożliwia przenoszenie genów oporności między gatunkami i rodzajami, natomiast transdukcja i transformacja- tylko w obrębie tego samego gatunku.
Pochodzenie genów antybiotykooporności
Wiele szczepów bakteryjnych niesie ze sobą pulę unikatowej informacji genetycznej, kodowanej w zwartych blokach DNA. Obecność analogicznych segmentów w genomach odległych filogenetycznie organizmów wskazuje na mobilność i możliwość ich przekazywania. Klastry genów oporności, bo o nich mowa, grupują determinanty różnego pochodzenia i są najczęściej obce dla bakteryjnego gospodarza. Źródłem genów, warunkujących antybiotykooporność są:
– producenci antybiotyków, u których geny te pełnią funkcje naturalnej samoobrony przeciwko wytwarzanej substancji;
– mutacje, zachodzące w genach metabolizmu podstawowego (ang. Housekeeping genes), w wyniku których dochodzi do przekształcenia mechanizmu biosyntezy czy rozkładu na mechanizm, warunkujący oporność;
– naturalne geny oporności, pochodzące od mikroorganizmów glebowych, które same produkują określony antybiotyk.
Geny kodujące oporność na antybiotyki odnaleziono na chromosomach, plazmidach, transpozonach, integronach oraz w tzw. kasetach genowych. Geny oporności, zlokalizowane na chromosomie, są rozprzestrzeniane na drodze podziału komórkowego, natomiast geny, zlokalizowane na ruchomych elementach genetycznych, są przekazywane albo podczas podziału komórkowego albo na drodze horyzontalnego transferu genów (HTG).
9. Literatura:
1. Alanis A.J., 2005. Resistance to antibiotics: are we in the post-antibiotic era? Archives of Med. Research 36: 697-705
2. Baj J., Markiewicz Z., 2007. Biologia molekularna bakterii. PWN, Warszawa.
3. Berger-Bächi B., McCallum N., 2006. State of knowledge of bacterial resistance. Int. J. Care Injured 37: S20-S25.
4. Brown T.A., 2001. Genomy. PWN, Warszawa.
5. Chmiel A., Grudziński S., 1998. Biotechnologia i chemia antybiotyków.PWN, Warszawa.
6. Courvalin P., 2006. Antibiotic resistance: the pros and cons of probiotic. Digestive Liv. Dis. 38: S261-S265. 7. Davison H.C., Low J.Ch., Woolhouse M., 2000. Antibiotic resistance and how we measure it? Trends Microbiol. 8: 554-559.
8. Davison H.C., Low J.Ch., Woolhouse M., 2000. Antibiotic resistance and how we measure it? Trends Microbiol. 8: 554-559.
9. Fluit A.C., Visser M.R., Schmitz F.-J., 2001. Molecular detection of antimicrobial resistance. Clin. Microbiol. Rev. 14: 836-871.
10. Hames B.D., Hooper N.M., Houghton J.D., 2001. Krótkie wykłady- Biochemia. PWN, Warszawa.
11. Hames B.D., Hooper N.M., Houghton J.D., 2001. Krótkie wykłady- Biochemia. PWN, Warszawa.
12. Harrison P.F., Lederberg J., 1998. Antimicrobial resistance: Issues and Options Workshop Report. Nat. Acad. Press, 104: 1-11.
13. Heczko P.B. (red), 2007. Mikrobiologia. Podręcznik dla pielęgniarek, położnych i ratowników medycznych. PZWL, Warszawa.
14. Kayser F.H., Bienz K.A., Eckert J., Zinkernagel R.M., 2007. Mikrobiologia lekarska. PZWL, Warszawa.
15. Koolman J., Röhm K.-H., 2005. Biochemia- ilustrowany przewodnik. PZWL, Warszawa.
16. Kowszyk-Gindifer Z., Sobiczewski W. (red), 1990. Antybiotyki współczesny
17. Kowszyk-Gindifer Z., Sobiczewski W. (red), 1990. Antybiotyki współczesny stan wiedzy. Przedsiębiorstwo Wydawnictw i Wystaw Chemii Przemysłu Chemicznego i Lekkiego „Chemil”, Warszawa.
18. Kunicki- Goldfinger W.J.H., 2005. Życie bakterii. PWN, Warszawa
19. Kwiatkowski Z.A., 1992. Oporność bakterii na antybiotyki. PWN, Warszawa.
20. Markiewicz Z., Kwiatkowski Z.A., 2001. Bakterie, antybiotyki, lekooporność.
21. Mathur S., Singh R., 2005. Antibiotic resistance in food lactic acid bacteria- a review. Int. J. Food. Microbiol. 105: 281-295.
22. Mazel D., Davies J., 1999. Antibiotic resistance in microbes. CMLS Cell. Mol. Life Sci. 56: 742-754.
23. Poole K., 2005. Efflux- mediated antimicrobial resistance. J. Antimicrob. Chemother. 56: 20-51.
24. Russel S., 1977. Antybiotyki. PWN, Warszawa.
25. Schlegel H.G., 2000. Mikrobiologia ogólna. PWN, Warszawa.
26. Singleton P., 2000. Bakterie w biologii, biotechnologii i medycynie. PWN, Warszawa.
27. Stryer L., 2005. Biochemia. PWN, Warszawa.
28. Turner P.C., Lenna A.G., Bates A.D., Wite M.R.H., 1999. Krótkie wykłady- Biologia molekularna. PWN, Warszawa.
29. Yoneyama H., Katsumata R., 2006. Antibiotic resistance in bacteria and its future for novel antibiotic development. Biosci. Biotechnol. Biochem. 70: 1060-1075.

