Białka rekombinowane są to białka uzyskiwane z rekombinowanych genów, czyli cząsteczek DNA złożonych z różnych fragmentów kwasów nukleinowych. Ich zastosowanie pozwala na wydajną produkcję tych peptydów, które w naturalnych warunkach występują w niewystarczających ilościach, np. insuliny stosowanej w farmaceutyce i podpuszczki niezbędnej do produkcji serów.
Produkcja białek rekombinowanych
Białka są związkami wielkocząsteczkowymi zbudowanymi z aminokwasów. Stanowią one największa grupą związków organicznych i pełnią wiele ważnych funkcji życiowych w wytwarzających je organizmach. Między innymi wchodzą w skład struktur komórkowych i płynów ustrojowych (kolagen, keratyna, albuminy), transportują i magazynują różne substancje (hemoglobina), warunkują odpowiedź immunologiczną organizmu (przeciwciała), regulują procesy metaboliczne (hormony, enzymy) oraz procesy krzepnięcia krwi (fibrynogen). Niedobór lub niewłaściwe funkcjonowanie białek stanowi przyczynę wielu groźnych chorób. Jedynym możliwym sposobem ich leczenia jest regularne uzupełnianie powstałych braków, np. podawanie insuliny osobom cierpiącym na cukrzycę.
Wiele białek, głównie enzymów jest również powszechnie wykorzystywanych w przemyśle chemicznym (np. przy produkcji proszków do prania) i spożywczym (np. renina niezbędna do produkcji serów podpuszczkowych).
Dawniej wszystkie białka pozyskiwano z tkanek żywych organizmów. Jednak ze względu na nieustannie rosnące zapotrzebowanie, tego typu metody okazały się mało wydajne. Problem niedoboru rozwiązano dzięki rozwojowi biotechnologii. Zastosowanie technik rekombinacji DNA umożliwiło masową produkcję prowadzoną w specjalnych systemach komórkowych, to znaczy w bakteriach, drożdżach, roślinach i zwierzętach, do których za pomocą odpowiednich wektorów wprowadzono namnożony transgen – fragment genu kodującego pożądane białko.
Aby możliwa była ekspresja zrekombinowanych genów, konieczne jest zastosowanie specjalnych wektorów ekspresyjnych. Nośniki te, oprócz elementów typowych dla wektora klonującego, zawierają również silny promotor, który umożliwia produkcję dużej ilości białka w komórce biorcy.
Wektory mogą być ponadto zaopatrzone w sekwencje regulujące stabilność syntetyzowanych peptydów i warunkujące sekrecję produktu docelowego, czyli jego wydzielanie poza komórkę gospodarza. Ich obecność znacznie ułatwia izolację i oczyszczanie pożądanej substancji.
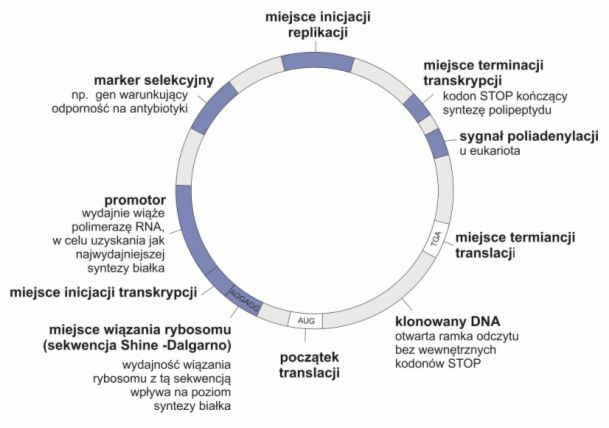
Rys. 1. Plazmidowy wektor ekspresyjny
Wydajana ekspresja białek wymaga zastosowania odpowiednich warunków. Ich rodzaj zależy od typu syntetyzowanego produktu. Zachodzi zatem konieczność indywidualnej optymalizacji całego procesu.
Problem nadprodukcji
Głównym celem podczas wytwarzania białek rekombinowanych jest ich nadprodukcja. To właśnie ona możliwia korzystną ekonomicznie realizację celów naukowych (badań nad ich funkcją i strukturą), terapeutycznych (terapia i profilaktyka chorób zarówno organicznych, jak i zakaźnych) oraz przemysłowych (np. enzymy wykorzystywane w przemyśle).
Aby uzyskać ten efekt często stosuje się wektory plazmidowe, to znaczy takie, które mogą występować w komórce w dużej liczbie kopii. Ich nadmiar niesie jednak za sobą ryzyko destabilizacji całego systemu. Niektóre komórki tracą pobrane plazmidy i w efekcie rosną szybciej niż te, które utrzymują dodatkowe geny. Dominując w prowadzonej kulturze zmniejszają ogólną wydajność ekspresji. Aby rozwiązać ten problem zaczęto stosować wektory wbudowujące się w informację genetyczną gospodarza. Choć obniżają one ogólny poziom ekspresji pożądanych białek, to jednak gwarantują stabilność ich produkcji.
W niektórych wypadkach nadprodukcja może stanowić nawet 30% wszystkich białek komórkowych. Zbyt intensywna synteza prowadzi często do odkłania się białek i formowania tak zwanych nierozpuszczalnych ciał inkluzyjnych.
Białka pochodzące z nadekspresji określonych genów w bakteriach mogą być także niestabilne ze względu na aktywność enzymów proteolitycznych gospodarza. Produkty docelowe chroni się przed degradacją zmieniając sekwencję nukleotydową wektora. Do N końca kodowanego polipeptydu dodaje się jeden lub kilka aminokwasów, których sekwencja może być później wykorzystana również do identyfikacji transkryptów (ang. tag sequence). Na samym końcu dodatkowe aminokwasy są usuwane enzymatycznie lub chemicznie.
Stała ekspresja wyczerpuje możliwości energetyczne komórki. Oprócz pełnienia funkcji biofabryki, musi ona nadal pełnić wszystkie niezbędne do przetrwania funkcje życiowe. Stosowane wektory powinny zatem umożliwiać włączanie i wyłączanie syntezy białka tzn. indukcję ekspresji klonowanej sekwencji, np. za pomocą temperatury lub dodawanych do pożywki metabolitów.
Bakteryjne systemy eskpresyjne
Pierwsze próby pozyskiwania białek rekombinowanych oparte były na bakteryjnych systemach ekspresyjnych. Tego typu metody nadal są stosowane do komercyjnej produkcji niektórych substancji.
Systemy bakteryjne najczęściej wykorzystują komórki pałeczki okrężnicy (Escherichia coli). Jest to organizm modelowy stosowany w eksperymentach inżynierii genetycznej i w związku z tym jego genom oraz warunki hodowli zostały bardzo dobrze poznane. Wiąże się to z szeroką dostępnością zarówno różnych szczepów, jak i wektorów, które mogą być użyte do badań. Inną zaletą E. coli jest stosunkowo niski koszt produkcji, gdyż bakteria ta rośnie dość szybko na tanich pożywkach.
Niepatogenne szczepy tej bakterii nie posiadają jednak efektywnych mechanizmów sekrecji białek do podłoża. W ich komórkach nie można również pozyskiwać niektórych typów cząsteczek, np. białek błonowych. W przypadku peptydów wytwarzanych do celów terapeutycznych, dużą niedogodnością jest także obecność lipopolisacharydu wchodzącego w skład ściany komórkowej wszystkich bakterii gram-ujemnych. Podczas izolacji może się on przedostawać do produkowanego białka i wywoływać gorączkę (to znaczy wykazywać właściwości pirogenne) w organizmie pacjenta.
Alternatywą jest stosowanie innych gatunków mikroorganizmów, np. gram-dodatnich bakterii Bacillus. Nie wytwarzają one lipopolisacharydu, co umożliwia późniejsze terapeutyczne zastosowanie uzyskiwanych w nich preparatów. Bakterie te posiadają również zdolność wydzielania dużych ilości białek do podłoża, czyli cechę znacznie ułatwiającą oczyszczanie pożądanych produktów.
Innym przykładem bakterii stosowanych do produkcji białek rekombinowanych są Lactococcus lactis, które stosuje się np. podczas otrzymywania peptydów błonowych.
Tabela 1. Szczepy E. coli najczęściej stosowane do produkcji rekombinowanych białek (według Staroń A. i in.)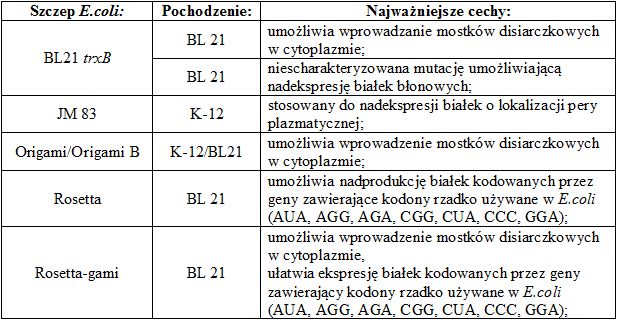
System ten ma jednak swoje słabe strony i to niezależnie od rodzaju zastosowanych bakterii.
Żadne organizmy prokariotyczne nie wycinają niekodujących fragmentów DNA. Z tego względu należy w nich używać klonów komplementarnego DNA (ang. complementary DNA; cDNA) połączonych z prokariotycznymi sygnałami transkrypcji i translacji. cDNA jest uzyskiwany dzięki odwrotnej transkrypcji przeprowadzanej na matrycy mRNA i w związku z tym nie zawiera intronów.
Ważna jest również wielkość transgenu. Białka o masie cząsteczkowej większej niż 30 kDa mogą ulegać nieprawidłowemu fałdowaniu w komórkach bakteryjnych.
W niektórych przypadkach produkty wprowadzonych genów są uznawane za obce. Dzieje się tak nawet wtedy, gdy wytwarzają je geny zintegrowane z chromosomem gospodarza. Bakteria może wówczas odrzucać i niszczyć nieznane sobie peptydy. Problem ten pokonano przygotowując tak zwane białka fuzyjne, czyli inaczej białka chimeryczne. Składają się one z połączonych ze sobą dwóch lub większej ilości genów, które pierwotnie nie były ze sobą związane i odpowiadały za produkcję osobnych peptydów.
Geny kodujące pożądane białko łączy się z genami kodującymi białka typowo bakteryjne, a powstały w ten sposób produkt fuzyjny jest rozpoznawany przez gospodarza jako jego własny i nie ulega degradacji. Wydzielone z hodowli białko należy pod koniec rozszczepić enzymatycznie i dopiero w ten sposób uzyskuje się pożądany produkt.
Jednym z największych ograniczeń jest jednak fakt, że żadne bakterie nie są zdolne do przeprowadzania mechanizmów modyfikacji posttranslacyjnej, takich jak np. cięcia enzymatyczne, glikozylacja. W większości przypadków są one kluczowe dla prawidłowej aktywności białek eukariotycznych. Produkty wytwarzane w systemach bakteryjnych mogą być zatem niestabilne lub nieaktywne biologicznie.
Tabela. 2. Najczęściej spotykane problemy i ich możliwe rozwiązania w eksperymentach nadekspresji białek w komórkach E.coli (według Staroń A. i in.)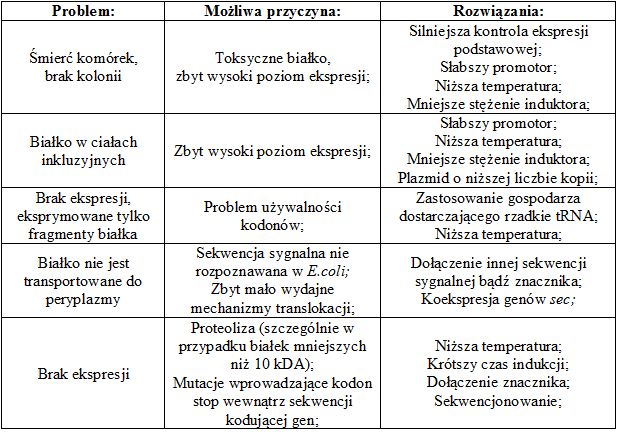
Eukariotyczne systemy ekspresyjne
Aby rozwiązać problem braku obróbki posttranslacyjnej opracowano systemy ekspresyjne opierające się na komórkach eukariotycznych. Uzyskiwane dzięki nim białka w większym stopniu przypominają formy natywne i mogą być wprowadzane do organizmu człowieka, a zatem służyć jako leki. W ten sposób otrzymuje się np. hormon wzrostu, β-interferon, białko krzepliwości krwi (czynnik VIII i IX), fibrynogen, erytropoetynę.
Ssacze wektory są wektorami wahadłowymi, inaczej bifunkcjonalnymi lub czółenkowymi (ang. shuttle). Oznacza to, że mają one dodatkową sekwencję charakterystyczną dla komórek prokariotycznych i dzięki temu mogą być namnażane w bakteriach. Dopiero potem DNA wprowadza się do komórek eukariotycznego gospodarza, to znaczy do miejsca, w których geny ulegną ekspresji. Najczęściej stosuje się elektroporację. Można też dodawać do zawiesiny komórek DNA wytrącony fosforanem wapnia.
Oprócz sekwencji promotorowych i sekwencji sygnałowych transkrypcji i translacji, eukariotyczne wektory ekspresyjne powinny posiadać również między innymi sekwencje sygnałowe poliadenylacji mRNA. Wektory te mogą występować w formie episomalnej (to znaczy pozostającej bez związku z genomem gospodarza) jako plazmidy lub też ulegać integracji z jednym z chromosomów komórki gospodarza.
W produkcji białek rekombinowanych szeroko stosowane są drożdże Saccharomyces cerevisiae, których genetyka i fizjologia zostały już dobrze poznane. Ich hodowla nie jest trudna, a wytworzone dzięki nim białka można łatwo oczyszczać wykorzystując do tego celu zjawisko sekrecji. Drożdżowe wektory ekspresyjne integrują się z genomem gospodarza lub też mają postać plazmidów zbudowanych na bazie endogennego plazmidu drożdżowego 2μ.
DNA wprowadza się do komórki na kilka sposobów, np. poprzez elektroporację lub usunięcie ściany komórkowej, to znaczy otrzymywanie protoplastów. Przykładowym produktem otrzymywanym w drożdżach jest insulina oraz, stosowany jako szczepionka, powierzchniowy antygen wirusowego zapalenia wątroby typu B.
Można także posługiwać się komórkami owadzimi, które wykorzystuje się do hodowli bakulowirusów. Jako wirusy infekujące bezkręgowce, są one naturalnie przystosowane do funkcji eukariotycznego wektora ekspresyjnego. Znajdujący się w ich genomie gen białka poliedryny pozostaje pod wpływem bardzo silnego promotora. Można go zastąpić genem docelowym, który w ten sposób łatwo zostaje przeniesiony do komórek gospodarza i ulega ekspresji na późnym etapie infekcji. Tak zwany system bakulowirusowy, jest bardzo efektywny pod względem sekrecji białek do podłoża. Kolejną jego zaletą jest to, że uzyskiwane w nim białka mają wzór glikozylacji zbliżony do wzoru swoich ssaczych odpowiedników. Komórki owadzie służą między innymi do produkcji antywirusowego białka – β-interferonu oraz erytropoetyny stosowanej u pacjentów cierpiących na anemię.
Powszechnie wykorzystuje się także mysie lub ludzkie linie komórek ssaczych. Przykładowo białko ludzkiego czynnika VIII (podawane osobom chorym na hemofilię) wytwarza się w liniach komórkowych chomika poddanych wcześniej transfekcji 186kpz fragmentem ludzkiego genomowego DNA. W porównaniu z komórkami mikroorganizmów komórki ssaków cechują się wolniejszym tempem translacji i fałdowania. W związku z tym są one lepszymi gospodarzami w przypadku produkcji białek błonowych. Ich wadą jest jednak stosunkowo niska wydajność idąca w parze z wysokimi kosztami całego procesu.
Obecnie produkcja białek rekombinowanych jest możliwa również z wykorzystaniem całych genetycznie zmodyfikowanych organizmów (ang. genetically modified organisms, GMO). Dzięki zastosowaniu metod inżynierii genetycznej zdołano skonstruować między innymi owce i kozy wydzielające do mleka odpowiedniki ludzkich białek. Wymienione czynniki najłatwiej byłoby uzyskać w surowicy krwi. Organizm zwierzęcia transgenicznego toleruje jednak tylko ograniczone ilości obcego produktu w swoich tkankach. Wydzielane na zewnątrz mleko nie tylko rozwiązuje ten problem, ale również jest produkowane w dużych ilościach i może być zbierane bez szkody dla wytwarzającego je zwierzęcia. Ponadto zawiera ono niewiele rodzajów białek, co znacznie ułatwia proces oczyszczania otrzymywanych w nim produktów. Doustne podawanie leku jest dogodne również z punktu widzenia pacjenta. W ten sposób produkuje się m.in. czynnik IX (krzepnięcie krwi) i białko osocza α1-antytrypsynę. Wykorzystanie zwierząt transgenicznych jest jednak bardzo kosztowne i budzi wiele kontrowersji na tle etycznym.
Produkcja białek w roślinach
Pierwsze eksperymenty dotyczące produkcji białek rekombinowanych w roślinach opisano około 25 lat temu. Wprowadzane geny ulegają ekspresji w określonych tkankach, np. w liściach, z których następnie oczyszcza się pożądany produkt.
Organizmy stosowane jako biofabryki nie są przeznaczone do celów spożywczych i nie mają nic wspólnego z genetycznie zmodyfikowaną żywnością. Pozostałe po nich odpadki poddaje się degradacji.
Produkcję białek rekombinowanych z użyciem roślin określa się mianem rolnictwa molekularnego (ang. molecular farming, plant biopharming, plant molecular farming (PMF)).
Najczęściej stosowanymi gatunkami są kukurydza, tytoń, ziemniaki i pomidory. Są to organizmy dobrze poznane zarówno pod względem genomu jak i najlepszych technik uprawy. Lista wytwarzanych w ten sposób białek (znajdujących się na różnych etapach badań) obejmuje między innymi przeciwciała i ich fragmenty, antygeny do produkcji szczepionek, enzymy i cytokiny. Otrzymywane produkty wykorzystuje się najczęściej w przemyśle farmaceutycznym, chemicznym i spożywczym.
Hodowla roślin jest bardzo wydajna i może być prowadzona na polu oraz w zamkniętych szklarniach. Zastosowanie tego typu biofabryk mogłoby zatem znacznie obniżyć koszty produkcji białek i w ten sposób wpłynąć na cenę i dostępność niektórych biofarmaceutyków. Zniwelowałoby to również ryzyko występowania zakażeń odzwierzęcych, gdyż powodujące je bakterie oraz priony nie mogą się rozwijać wewnątrz roślin. Ponadto, produkowane w ten sposób szczepionki mogłyby być podawane w postaci pokarmu, to znaczy bez konieczności iniekcji, która stanowi mniej przyjemną i bardziej inwazyjną metodę wprowadzania leków do organizmu.
Duże obawy wśród społeczeństwa wzbudza jednak ryzyko przypadkowego spożycia zmodyfikowanych roślin. Ich części, np. pyłki mogłyby zanieczyść maszyny rolnicze i przedostać się do upraw przeznaczonych na cele spożywcze. Wątpliwości budzi również wpływ roślin GM na mikroorganizmy glebowe.
Białka rekombinowane w medycynie
Pierwotnie potrzebne białka izolowano i oczyszczano z organizmów zwierzęcych lub uzyskiwano je od ludzkich dawców. Metoda ta była jednak mało wydajna. Ponadto, białka pobrane od innych gatunków wykazywały różnice funkcjonalne, a ich stosowanie niosło ze sobą ryzyko wstąpienia groźnych zakażeń, np. wirusami HIV, prionami CJD.
Zastosowanie białek rekombinowanych zwiększa wydajność produkcji leków i ich dostępność Niweluje problem niezgodności i ogranicza do minimum zagrożenie związane z przenoszeniem czynników chorobotwórczych.
Tabela. 3. Niektóre leki o charakterze rekombinowanych białek (według Ratledge C. i in.)
| Grupa leków | Przykłady białek |
cytokiny i antagoniści | Interferon alfa-2a Interferon alfa-2b Interferon alfacon-1 Peginterferon alfa-2a Peginterferon alfa-2b Interferon beta-1a Interferon beta-1b Interferon gamma-1b Aldesleukin (IL-2) Filgrastim (G-CSF) Pegfilgrastim Lenograstim (G-CSF) Molgramostim (GM-CSF) Sargramostin (GM-CSF) Tasonermin (TNF-α) Becaplermin (PDGF-BB) Oprevelkin (IL-II) Anakinra (IL-IRA) |
| hormony i peptydy | Insulina Insulina lispro Insulina aspart Insulina glargine Epoetyna alfa (erytropoetyna) Epoetyna beta (erytropoetyna) Epoetyna delta (erytropoetyna) Darbepoetyna-alfa Folitropina alfa Folitropina beta Glukagon Somatotropina Lutropina-alfa Teriparatide (PTH I-34) Kalcytonina z łososia Tyrotropina-alfa Choriogonadotropina A2 Osteogeniczne białko 1 Dibotermina alfa (BMP-2) Pegvisomat (antagonista hGH) Nesirtide (peptyd natriuretyczny) |
| czynniki krzepliwości i inhibitory | Eptacog alfa Czynnik antyhemofilowy Moroktokog alfa (muteina FVIII) Nonacog alfa Desirudyna Lepirudyna Drotrekogina alfa (aktywowana białkiem C) Inhibitor α1-proteinazy |
| enzymy | Alteplaza (t-PA) Reteplaza (muteina t-PA) Tenekteplaza (muteina t-PA) Monteplaza (muteina t-PA) Dornaza-alfa (RNaza) Imigluceraza Agalzydaza alfa Agalzydaza beta Resburykaza Laronidaza |
| szczepionki | Szczepionka przeciw zapaleniu wątroby Szczepionka przeciw boreliozie Szczepionka di-per-te (przeciw błonicy, teżcowi I krztuścowi) Szczepionka przeciw rotawirusom |
| białka fuzyjne | Denileukin diftitoks Etanercept Alefacept |
Tłustym drukiem zaznaczono białka stosowane w zmodyfikowanej formie (w porównaniu z oryginalnym białkiem ludzkim).
Niektóre z przedstawionych białek zostały wprowadzone do handlu pod różnymi nazwami przez różne przedsiębiorstwa farmaceutyczne. Dokładniejsze informacje na temat poszczególnych leków białkowych znajdują się na stronach internetowych producentów.
Białka rekombinowane w przemyśle
Wykorzystanie technologii rekombinacji DNA pozwala na modyfikację uzyskiwanych białek. Jest to tak zwana inżynieria białek. Dzięki temu można polepszyć właściwości uzyskiwanych produktów, np. enzymy odporne na wysoka temperaturę lub o zmienionej specyficzności względem substratu.
Dużą popularnością cieszy się potencjalne zastosowanie roślin do uzyskiwania biodegradowalnych plastików (Metabolix company). Innym użyciem mogłaby być produkcja olejów przemysłowych, takich jak oleje hydrauliczne lub wysokowydajne biodiesle, nowe biopaliwa stałe, włókna i papiery.
Tabela. 4. Przykładowe białka rekombinowane stosowane w przemyśle (według Winter P.C. i in.)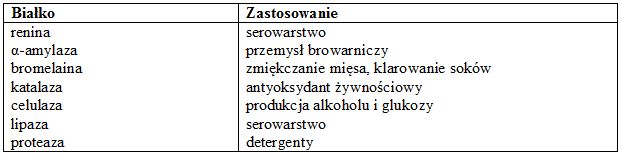
Autor: Anna Kurcek
Literatura:
1. Bishop J., 2001. Ssaki transgeniczne. Wydawnictwo Naukowe PWN. Warszawa.
2. Canadian Institute for Environmental Law and Policy. 2006. Plant Molecular Farming (PMF.)
3. Ratledge C., Kristiansen B., 2011. Podstawy biotechnologii. Wydawnictwo Naukowe PWN.
4. Sirko A., Vaněk T., Góra-Sochacka A., Redkiewicz P., 2011. Recombinant Cytokines from Plants. Int. J. Mol. Sci. 12: 3536-3552. Spök A., Karner S., 2008. Plant Molecular Farming Opportunities and Challenges. JRC European Comission.
5. Stryer L., 2003. Biochemia. Wydawnictwo Naukowe PWN. Warszawa.
6. Turner P.C., McLennan A.G., Bates A.D., White M.R.H., 2007. Krótkie wykłady. Biologia molekularna. Wydanie drugie. Wydawnictwo Naukowe PWN.
7. Staroń A., Grabowska A., Jagusztyn-Krynicka E. K., 2008. Nadprodukcja i oczyszczanie rekombinowanych, heterologicznych białek w komórkach Escherichia coli. Postępy Mikrobiologii 47 (2): 83-95.
8. Winter P.C., Hickey G.I., Fletcher H.L., 2004. Krótkie wykłady. Genetyka. Wydanie drugie. Wydawnictwo Naukowe PWN.
9. http://www.molecularfarming.com/

