Autor: Iga Kołodziejczak, Doktorant SMM, Warszawski Uniwersytet Medyczny
Przedmiotem zainteresowania mikrobiologii są bakterie, grzyby i wirusy. W zależności od stopnia i rodzaju interakcji między człowiekiem a mikroorganizmami były one albo zwalczane, albo wykorzystywane przez człowieka do określonych celów. Mikroorganizmy stanowiące zagrożenie dla życia lub dobrostanu ludzi, takie jak te, które wytwarzają endotoksyny lub wyrządzające jakiekolwiek szkody, podlegały eliminacji, a wraz z rozwojem możliwości – metodom identyfikacji. Natomiast w przypadku mikrobów, których hodowla przynosiła wymierne korzyści, za pomocą rozmaitych technik prowadzenia hodowli utrzymywano ciągłość gatunku i następnie – w celu zwiększenia efektywności działania mikroorganizmów – modyfikowano je w taki sposób, by wykorzystywać je z maksymalną wydajnością.
Miejscem bytowania drobnoustrojów jest nie tylko otoczenie (woda, gleba, powietrze), ale również powierzchnia roślin, ciał zwierząt i ludzi, błony śluzowe wyściełające jamy ciała mające kontakt ze środowiskiem zewnętrznym (drogi oddechowe, pokarmowe) oraz obumarłe organizmy zwierzęce, roślinne, tkanki i narządy osobników zdrowych i chorych (1). Większość mikroorganizmów zasiedlających powłoki ludzkiego ciała to naturalni komensale, niemniej wśród nich mogą znaleźć się mikroorganizmy niebezpieczne i niewrażliwe na działanie współcześnie stosowanych terapeutyków.
Jak wiadomo, mikroorganizmy to również idealne narzędzie dla bioterrorystów, którzy mogą być w posiadaniu mikroorganizmów chorobotwórczych lub ich metabolitów. Dlatego niezwykle istotne jest opracowanie narzędzi pozwalających na możliwie jak najszybsze zidentyfikowanie i usunięcie ewentualnego zagrożenia.
Obecnie stosowane techniki wykrywania drobnoustrojów są najczęściej długotrwałymi i kosztownymi procedurami. W związku z tym, poszukuje się innowacyjnych metod detekcji, do których bez wątpienia można zaliczyć biosensory.
Dzięki rozwojowi biotechnologii i nanotechnologii, skonstruowano bardzo czułe i selektywnie działające biosensory, które pozwalają na szybką detekcję zanieczyszczeń biologicznych i chemicznych. Bioczujniki stanowią zatem połączenie sprawdzonych metod konwencjonalnych z niemalże nieograniczonymi możliwościami rozwiązań konstrukcyjnych (2). Należy wspomnieć, że pomiary biosensoryczne nie wykazują konieczności uprzedniego pracochłonnego przygotowania próbki do analizy, a samych biosensorów można używać wielokrotnie, obniżając tym samym koszty badań. Ze względu na dużą czułość i łatwość obsługi biosensory stosowane są w szeroko pojmowanej diagnostyce mikrobiologicznej: w analizie klinicznej, przemyśle czy inżynierii środowiska (3).
Biosensory: struktura, klasyfikacja
Pierwszy biosensor został opisany stosunkowo niedawno, w 1962 r. przez Lelanda Clarka i Champa Lyonsa. Konstrukcja opracowanego przez nich bioczujnika opierała się na amperometrycznym oznaczaniu glukozy z wykorzystaniem elektrody tlenowej i modyfikacji powierzchni oksydazą glukozową (4). Od tamtego czasu opracowano bardziej zaawansowane, czulsze i niezawodne bioczujniki.
Współcześnie, wg Międzynarodowej Unii Chemii Czystej i Stosowanej (International Union of Pure and Applied Chemistry, IUPAC) biosensor definiuje się jako „samowystarczalne, zintegrowane urządzenie dostarczające specyficznych, ilościowych lub półilościowych informacji analitycznych przy użyciu biologicznych elementów rozpoznających (receptorów biochemicznych) umieszczonych w bezpośrednim kontakcie z przetwornikiem elektrycznym”. Należy zwrócić uwagę na fakt, że biosensor to składowa systemu bioanalitycznego, dostarczającego informacji ilościowej bądź jakościowej na temat obecności w jego otoczeniu określonych analitów. Biosensor to czujnik wielokrotnego użytku i to właśnie wyróżnia go od powszechnie stosowanych biosond, które są jednorazowego użytku lub uniemożliwiają proces ciągłego monitorowania stężenia analitu, czyli np. pierwiastka, jonu bądź związku chemicznego oznaczanego w danej próbie.
Każdy biosensor, po pojawieniu się sygnału w warstwie receptorowej (gdzie dochodzi do procesu detekcji) przetwarza sygnał o obecności analitu do wielkości fizycznej, która może być rejestrowana za pomocą sygnałów elektrycznych (napięcie, prąd) bądź sygnałów optycznych.
Z technicznego punktu widzenia, biosensor składa się z dwóch komponentów: bioreceptora, i przetwornika. Biosensor stanowi element warunkujący specyficzność czujnika. Najczęściej stosowanymi receptorami w biosensoryce są enzymy, przeciwciała, kwasy deoksyrybonukleinowe i rybonukleinowe, które są zaangażowane w proces specyficznej detekcji określonego analitu. Mimo faktu, iż procedury immobilizacji przeciwciał i kwasów nukleinowych są dobrze poznane, to częściej jako receptorów w sensorach wykorzystuje się enzymy, będące białkami katalizującymi reakcje biochemiczne we wszystkich żywych organizmach (5). Enzymy wyróżniają się wysoką selektywnością w stosunku do substratów i przyspieszają zachodzenie reakcji, tym samym zwiększając czułość biosensorów. Przetwornik natomiast służy do zamiany sygnału (bio)chemicznego powstającego wskutek interakcji analizowanej próbki z bioreceptorem na sygnał elektroniczny. Najczęściej amplituda powstałego sygnału pozostaje w bezpośredniej relacji z natężeniem wykrywanego bodźca związanego ze stężeniem analitu. Elektrochemiczne przetworniki są często używane w konstrukcji biosensorów dzięki licznym zaletom, wśród których należy wymienić: możliwość prowadzenia badań bezpośrednio w miejscu poboru próbki, prostotę obsługi, niewielkie rozmiary oraz niskie koszty związane z pomiarami w niewielkiej objętości próbki i względnie tanią aparaturą (w porównaniu do diagnostycznych metod klasycznych) (6)(7).
Bardzo istotną kwestią podczas konstruowania biosensora jest immobilizacja elementu biologicznego na powierzchni przetwornika w celu zagwarantowania stabilizacji biomateriału i konieczną do prawidłowego działania biosensora wzajemną bliskość bioczujnika i odbiornika. Immobilizacja to szereg metod, które całkowicie lub w pewnym zakresie ograniczają możliwość swobodnego poruszania się pewnych molekuł, substancji czy materiałów biologicznych na stałym podłożu lub wewnątrz specjalnych struktur. Unieruchomienia dokonuje się w wyniku fizycznej adsorpcji, usieciowienia cząsteczek, kowalencyjnego wiązania oraz zamknięcia wewnątrz błony, mikrokapsuły czy polimeru. W konsekwencji połączenia elementów biosensora w spójną całość otrzymuje się urządzenie pozwalające na bardzo szybką, czułą i precyzyjną identyfikację nawet niewielkiego miana związków wykazujących działanie toksyczne, kancerogenne lub mutagenne w stosunku do organizmów żywych (8).
Na proces pomiaru z zastosowaniem biosensora składają się trzy główne etapy. Na początku komponent biologiczny rozpoznaje specyficznie interesujący związek. Następnie, w warstwie detekcyjnej biosensora, zachodzi reakcja, której efekt – sygnał biologiczny – zostaje przekształcony przez przetwornik w możliwy do zmierzenia sygnał elektroniczny. Pomiar zjawisk biologicznych zachodzących w bioczujniku odbywa się za pomocą detektorów optycznych, termicznych, akustycznych bądź elektrochemicznych (amperometrycznych, potencjometrycznych, konduktometrycznych). Przetwarzanie sygnału biologicznego polega na obróbce otrzymanej odpowiedzi analitycznej i wzmocnieniu oraz rejestracji danego sygnału (Rys. 1.).
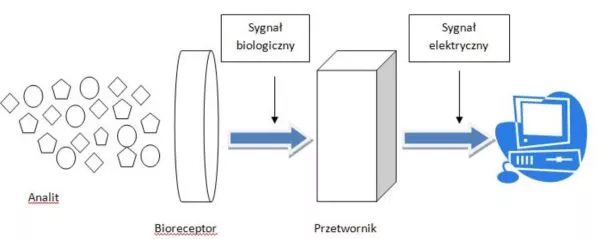
Rys. 1. Schemat biosensora (9).
Klasyfikacji biosensorów dokonuje się na bazie metody przetwarzania sygnału biologicznego (elektrochemiczne, optyczne akustyczne, termiczne), zastosowanego biologicznego elementu wykrywającego (np. enzymatyczne, receptorowe, aptamery) lub rodzaju identyfikowanej substancji. Podziału biosensorów również można dokonać ze względu na rozwiązania jakościowe (do których należą testy diagnostyczne do monitorowania określonego zanieczyszczenia) i ilościowe (przedstawiające zmiany chemiczne zachodzące w środowisku, zwłaszcza powodujące nieprawidłowości w funkcjonowaniu układów biologicznych). Poniższy schemat obrazuje podział biosensorów ze względu na sposób przekazywania sygnału (Rys. 2.).
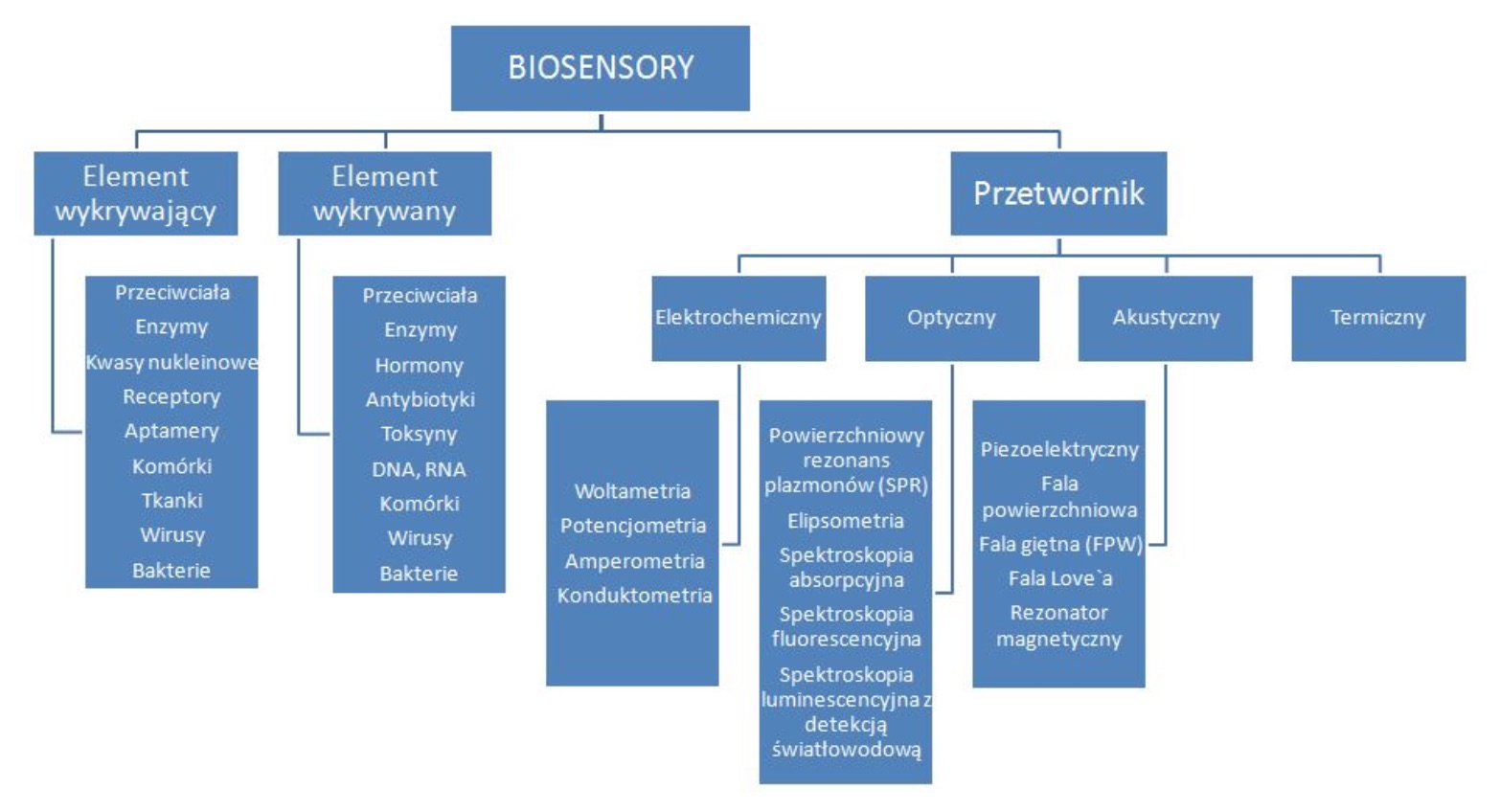
Rys. 2. Składowe biosensorów i ich podział (10).
Podstawowe parametry analityczne biosensorów
Wśród podstawowych parametrów opisujących działanie biosensorów należy wymienić:
liniowość – zakres odpowiedzi na bodziec stymulujący, z którym czujnik pozostaje w zależności liniowej;
czułość – najmniejsza wartość wahania stężeń jakie czujnik jest w stanie zarejestrować mierzona stężeniem substratu poprzez odpowiedź elektrodową;
powtarzalność odpowiedzi sygnału – podczas wielokrotnego oznaczania próbek o jednakowych stężeniach otrzymywane wartości każdorazowo powinny być identyczne;
selektywność – specyficzność względem badanej substancji, będąca zdolnością sensora do pomiaru stężenia jednego składnika chemicznego w obecności innych;
czas reakcji (szybkość czasu detekcji) – czas konieczny do otrzymania 95% wyników;
stabilność i okres operacyjny stosowania – próbki biologiczne z reguły charakteryzują się niestabilnością w zmiennych warunkach środowiskowych. Z uwagi na ten fakt, komponent biologiczny biosensora powinien zostać połączony w taki sposób, by jego aktywność została zatrzymana na całkowity czas pomiaru (9)(11).
Nanostruktury oraz biosensoryka
Współcześnie obserwuje się znaczny postęp w dziedzinie nanotechnologii, której obszar zainteresowań skupia się na otrzymywaniu i stosowaniu nowych materiałów lub ich całych komponentów (przetworników, układów scalonych), które mogą znaleźć zastosowanie w produkcji nowych urządzeń elektronicznych o wymiarach w skali nanometrowej.
Pierwsze wzmianki o możliwościach manipulacji materią w skali subnanometrowej pochodzą z 1959 r., kiedy przedstawiono możliwości otrzymywania tworzyw poprzez działania na poziomie pojedynczych atomów (przedrostek „nano” pochodzi z greki, od słowa „karzeł”), natomiast terminu „nanotechnologia” użyto po raz pierwszy w 1974 r. (12). Do rozwoju nanotechnologii przyczynił się niewątpliwie przemysł elektroniczny, kładący szczególny nacisk na rozwój zminiaturyzowanych urządzeń elektronicznych na chipach.
Możliwości zastosowania nanotechnologii w biosensoryce skupiają uwagę licznych grup badawczych na nanocząstki o zróżnicowanym kształcie (kulki, pręty, struktury kubiczne) wykonane ze złota, materiałów ferromagnetycznych oraz liposomów, których wszystkie trzy wymiary zostały przeniesione do skali nano (12).
Nanotechnologiczne układy elektroniczne, takie jak: tranzystory, diody, druty czy przetworniki akustyczne, których komponenty wykazują nanometrowe rozmiary stanowią bazę do konstrukcji biosensorów.
Przegląd biosensorów z procesem detekcji za pomocą pomiarów elektrycznych
Jedną z grup czujników wytwarzanych na masową skalę są czujniki z powierzchniową falą akustyczną. Czujniki te wytwarzane są z wykorzystaniem konwencjonalnej techniki fotolitografii i wytrawiania na mokro. Półprodukt, jakim jest przetwornik akustyczny, po odpowiedniej obróbce może znaleźć szerokie zastosowania w fizykochemicznych analizach próbek wody lub analizach mikrobiologicznych. Wykorzystanie tego typu czujników jest możliwe w mikrobiologii dzięki zastosowaniu przeciwciał odpowiedzialnych za specyficzny wychwyt wykrywanych komórek bakteryjnych. Przykładem takiego rozwiązania jest biosensor opracowany przez zespół pod kierownictwem E. Berkenpas, P. Millard do detekcji Escherichia coli szczepu O157:H7.
Układ ten zbudowano na bazie platformy, którą stanowił czujnik z powierzchniową falą akustyczną (przetwornik akustyczny), pomiędzy którego elektrody wprowadzono warstwę złota, poddaną kowalencyjnej funkcjonalizacji za pomocą przeciwciał (Rys.3.a). Skonstruowany w ten sposób układ bioanalityczny umożliwiał detekcję komórek bakteryjnych dzięki analizie sygnału akustycznego ulegającego propagacji wzdłuż warstwy złota z immobilizowanymi przeciwciałami (Rys. 3.b) Źródłem sygnału akustycznego jest jedna z elektrod palczastych przetwornika akustycznego, przyłączona do źródła sygnału o częstotliwości 92 Hz. Sygnał akustyczny powstały na zakończeniach rozprzestrzenia się wzdłuż powierzchni złota z immobilizowanymi przeciwciałami w kierunku drugiej elektrody pełniącej funkcję konwertora sygnału akustycznego na sygnał elektryczny, co pozwala na stwierdzenie obecności komórek bakteryjnych na powierzchni czujnika. Z fizycznego punktu widzenia sygnał powstały z udziałem nanoelektrod ulega modyfikacji na skutek propagacji wzdłuż ośrodka wysyconego związanym analitem – komórkami bakteryjnymi, które wykazują zupełnie inną impedancję akustyczną, a tym samym przyczyniają się do zmian kierunku propagacji, a nawet amplitudy sygnałów akustycznych (Rys. 3.c)(13).
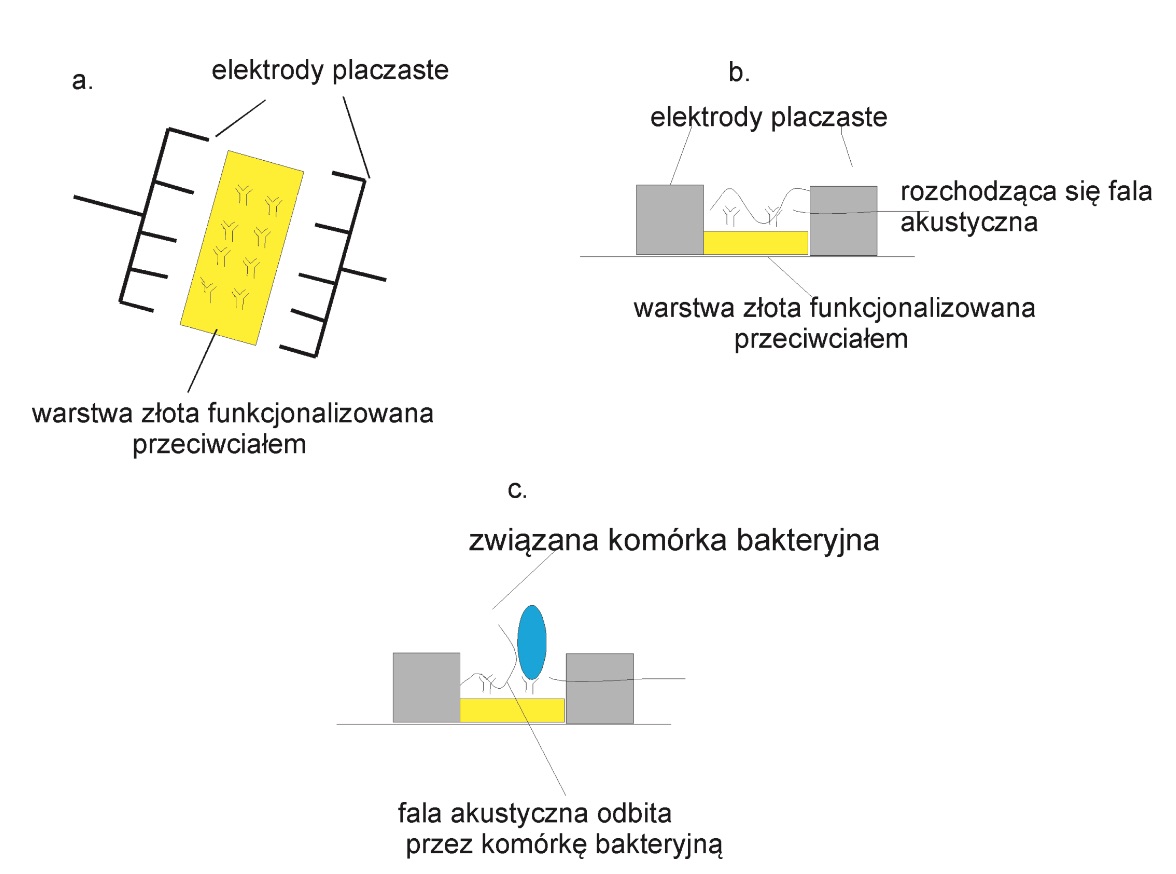
Rys. 3. Biosensor z powierzchniową falą akustyczną, a. schemat sensora, b. propagacja fali akustycznej w sytuacji braku analitu, c. propagacja fali w obecności komórek bakteryjnych (zjawisko odbicia).
W ostatnim dwudziestoleciu obserwuje się wzrost zainteresowania nanostrukturami węglowymi, które służą jako komponenty licznych struktur elektronicznych. Ich unikalne właściwości wynikają ze struktury elektronowej atomów sąsiadujących ze sobą w utworzonej przez nie warstwie (14). Jednościenne nanorurki węglowe wykazują wysoką biokompatybilność z licznymi biomolekułami takimi jak białka czy kwasy nukleinowe, a struktura węglowa ulega modyfikacji pod wpływem otaczających je czynników. Dlatego materiały te mogą znaleźć zastosowanie w biosensoryce (15). Jednym z przykładów sensorów bazujących na nanorurkach węglowych jest sensor opracowany przez grupę Yamady. Sensor ten został wykonany z płytki, na powierzchni której wytworzono połączenia elektryczne, a następnie naniesiono nanorurki węglowe z roztworu koloidalnego, dzięki czemu udało się uzyskać matrycę czujnika dwuanalitowego. Na otrzymanej matrycy immobilizowano w różnych regionach dwa typy przeciwciał – jedno z nich ukierunkowane na detekcję bakterii E. coli, drugie na S. aureus (Rys.4.a.). Otrzymano w ten sposób platformę diagnostyczną umożliwiającą jednoczesną detekcję dwóch drobnoustrojów z wykorzystaniem pomiarów rezystancyjnych pomiędzy dwoma różnymi wyprowadzeniami matrycy diagnostycznej (oznaczenia 1, 2, 3 i 4 na Rys. 4.b.).
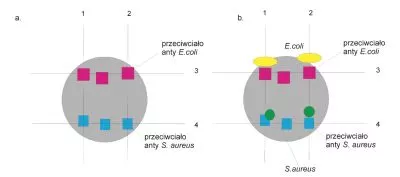
Rys. 4. Sensor rezystancyjny do detekcji E. coli i S. aureus: a. układ matrycy diagnostycznej, b. zasada działania.
Tak przygotowany biosensor potrafi wykryć do 102 j.t.k. (jednostek tworzących kolonie) w próbce o objętości 1 ml w czasie jednej minuty (16).
W związku z zapotrzebowaniem na coraz powszechniejsze rozwiązania bezprzewodowe, pojawiły się informacje na temat sensorów wykonanych za pomocą tej technologii. Przykład takiego rozwiązania dedykowany detekcji bakterii na powierzchni zębów opisał Mannoor i współpracownicy. Sensor wytworzono na podłożu z jedwabiu z nadrukowaną warstwą grafenu (17), którą poddano funkcjonalizacji za pomocą bioreceptora peptydowego. Tę konstrukcję przeniesiono na układ elektryczny składający się z cewek indukcyjnych oraz kondensatorów (Rys. 5.). Zastosowany bioreceptor to cząsteczka zawierająca dwa motywy funkcjonalne: peptyd GBP (graphene binding peptide) wiążący grafen oraz peptyd AMP (anit microbal peptide), który wykazuje specyficzność względem Escherichia coli, Helicobacter pylori i Staphylococcus aureus (Rys. 5.)
Włączenie do opisanego układu cewki rezonansowej (pełniącej funkcję anteny) wyeliminowało konieczność podłączenia biosensora do prądu i zastosowania dodatkowych, zewnętrznych przewodów. Wytworzona rozległa powierzchnia sensora wytworzona z grafenu funkcjonalizowanego peptydem GBP-AMP stanowi matrycę czujnika, na której zachodzi wysoce specyficzna detekcja komórek bakteryjnych. W przypadku rozpoznania i związania bakterii i ich elementów komórkowych przez immobilizowane peptydy, modulowane jest przewodnictwo elektryczne błony grafenowej i następnie bezprzewodowo monitorowane za pomocą urządzenia odczytującego wykorzystującego częstotliwość radiową. Bezprzewodowy biosensor charakteryzuje się górną granicą wykrywania na poziomie 〖10〗^3 komórek bakteryjnych w 1 ml próbki badanej (18).
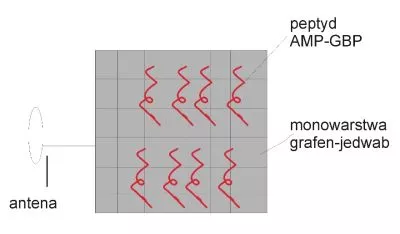
Rys. 5. Schemat sensora bezprzewodowego do detekcji bakterii z receptorem w postaci peptydu.
Inne rozwiązanie diagnostyczne wykorzystujące nanostruktury jakimi są polianilinowe nanorurki i nanowłókna tworzące sieci zaproponował poznański zespół pod kierunkiem Langera. Właściwości fizykochemiczne sieci włókien polianilinowych oraz interakcja polianiliny z biomolekułami i komórkami wsparta działaniem tranzystora polowego umożliwiają ciągłą, przepływową analizę próbek. Detekcję sygnału umożliwia modyfikacja przewodnictwa elektrycznego nanowłókien polianilinowych przez żywe komórki (Rys. 6.b.). Prezentowany układ posiada szereg zalet wśród których należy wymienić: brak konieczności zastosowania przeciwciał (co znacznie obniża koszt biosensora) oraz brak konieczności regeneracji sygnału generowanego przez biosensor dzięki działaniu w układzie przepływowym. Limit detekcji nanobiodetektora polianilinowego zależy od typu wykrywanych mikroorganizmów – dla drożdży wynosi 300, natomiast dla bakterii: 1,9*105 komórek na 1 ml analizowanej próby. Mimo braku elementu zapewniającego specyficzność w konstrukcji sensora (przeciwciała, aptamery) układ ten może nie tylko być stosowany do analiz ilościowo-jakościowych próbek płynnych, ale może być również używany do identyfikacji drobnoustrojów, co jest możliwe dzięki analizie kształtu sygnału (Rys. 6.a.)(19).
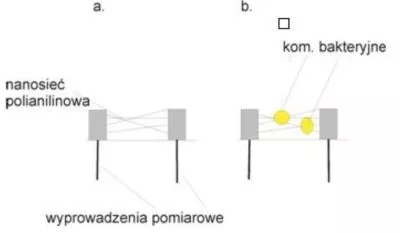
Rys. 6. Biosensor z układem nanosieci polianilinowych do detekcji drobnoustrojów: a. schemat sensora, b. proces wychwytu komórek w nanosieci polianilinowej.
Tranzystory to przyrządy półprzewodnikowe powszechnie wykorzystywane w dzisiejszych czasach, dlatego też liczne prace z zakresu biosensoryki koncentrują się na zastosowaniu ich w rozwiązaniach bioanalitycznych. Biosensory wykorzystujące tranzystor polowy z powodzeniem wykrywają pojedyncze cząstki wirusów, komórki bakterii i inne patogeny. Dzięki zastosowaniu tranzystorów bioczujniki te odznaczają się wysoką czułością i możliwością wielokrotnego zastosowania, a do efektywnej analizy wymagają jedynie niewielkiej ilości/objętości próbki. W celu konstrukcji tego typu sensorów wykorzystuje się technikę fotolitografii (20).
W rozwiązaniu zaproponowanym przez So, między elektrody oddalone od siebie o 500 nm wprowadzono węglowe nanorurki. Jako elementy rozpoznające analit wykorzystano aptamery będące syntetycznie otrzymanymi oligonukleotydami DNA lub RNA, których funkcją jest rozpoznawanie komórek bakteryjnych danego gatunku. Immobilizacji aptamerów na powierzchni nanorurek dokonano za pośrednictwem streptawidyny silnie oddziałującej z biotyną przyłączoną do 3’ końca aptamerów. Wykrywanie obecności bakterii za pomocą tego układu jest możliwa dzięki pomiarom zmian przewodnictwa. Komórki bakteryjne związane na powierzchni biosensora są czynnikiem modyfikującym przewodnictwo tranzystora: gdy komórka np. E. coli zetknie się ze strukturą sensora, odnotowuje się spadek przewodnictwa. Dzięki zastosowaniu tej metody, możliwa jest detekcja 109 komórek bakteryjnych znajdujących się w 1 ml analizowanej próby (21).
Przegląd biosensorów optycznych
Oprócz rozwiązań z procesem detekcji opartym o pomiary elektryczne, sensoryka powszechnie bazuje na rozwiązaniach optycznych wykorzystujących nanocząstki złota, srebra czy kadmu.
Jednym z ciekawszych rozwiązań optycznych jest biosensor fluorescencyjny oparty na nanocząsteczkach z siarczku kadmu. Sensor ten znalazł zastosowanie w identyfikacji bakterii redukujących siarczki dzięki naturalnie zachodzącemu procesowi znakowania komórek fluorescencyjnymi nanocząsteczkami. W układzie tym na szczególną uwagę zasługuje prosta konstrukcja, jaką stanowi pożywka bakteryjna wzbogacona siarczkiem kadmu, który pod wpływem aparatu enzymatycznego wykrywanych bakterii stanowi substrat do syntezy nanocząstek. Detekcja za pomocą takiego rozwiązania charakteryzuje się niskim kosztem analiz, szybkością i wysoką specyficznością przy limicie detekcji na poziomie 100 j.t.k. (jednostek tworzących kolenie) w jednym mililitrze pożywki Sam proces detekcji jest możliwy dzięki emisji fluorescencji o długości fali 520 nm przez wytworzone przez bakterie nanocząstki kadmu (22).
Innym rozwiązaniem optycznym dedykowanym do analiz mikrobiologicznych jest światłowodowy sensor do detekcji E.coli. Sensor ten zasługuje na szczególną uwagę ze względu na konstrukcję: jego podstawowym elementem jest światłowód modyfikowany dendrymerem poliaminodiaminowym, który pokryto nanocząstkami złota, a następnie poddano funkcjonalizacji bakteriofagiem T4 wykazującym wysoką specyficzność względem E. coli. Detekcja bakterii możliwa jest dzięki spektrofotometrycznym pomiarom wiązki światła transmitowanej przez światłowód, która ulega modyfikacji na skutek zmian właściwości nanocząstek złota pod wpływem związania przez faga komórek bakteryjnych. Przeprowadzone badania wykazały wysoką specyficzność tego rozwiązania, możliwość detekcji komórek w 1 ml roztworu zawierającego około 10 000 j.t.k. drobnoustrojów (23).
Podsumowanie
Z uwagi na fakt, że drobnoustroje to jeden z czynników stanowiących zagrożenie dla zdrowia i gospodarki człowieka, istnieje potrzeba udoskonalania obecnie stosowanych metod diagnostyki mikrobiologicznej oraz poszukiwania zupełnie nowych rozwiązań diagnostycznych. Zapotrzebowanie to ma związek z coraz większą koniecznością zabezpieczania się przed zakażeniami i skażeniem środowiska, w którym bytuje człowiek, np. w przemyśle spożywczym, w którym mikroorganizmy stanowią podstawę procesu produkcyjnego, a kontrola mikrobiologiczna musi spełniać wszelkie normy, by zapewnić całkowite bezpieczeństwo, a także monitorowanie środowiska przyrodniczego w celu eliminacji patogenów zagrażających życiu ludzi i zwierząt.
Metody analityczne obecnie stosowane w mikrobiologii to procedury czasochłonne, dlatego dąży się do opracowania nowych szybkich i tanich rozwiązań diagnostycznych. Wymagania te z powodzeniem spełniają biosensory, których intensywny rozwój obserwuje się od momentu opracowania pierwszego tego typu rozwiązania przez Clarka.
W konstrukcji biosensorów coraz częściej spotyka się nanostruktury, które w połączeniu z różnymi rodzajami receptorów stanowią doskonałe narzędzie do projektowania nowych rozwiązań diagnostycznych, integrując najnowsze dokonania z dziedziny biotechnologii i nanotechnologii. Ciągły proces udoskonalania biosensorów prowadzi do uzyskania metod wykazujących szereg zalet i znacznie przewyższających właściwościami dotychczas znane, konwencjonalne metody diagnostyczne.
Dobrze poznane i powszechnie stosowane metody hybrydyzacyjne takie jak PCR (Polymerase Chain Reaction) czy RT-PCR (Real-Time PCR) charakteryzują się bardzo wysoką czułością i specyficznością, jednak wymagają dużego nakładu finansowego (specjalistyczne laboratorium wyposażone w odpowiednią aparaturę i odczynniki) i czasowego (przygotowanie próbki do analizy, kilka godzin reakcji, czasochłonna analiza końcowa). Biosensory, choć nieco mniej czułe – jednak wciąż przodujące pod tym względem w porównaniu do klasycznych technik mikrobiologii – rekompensują tę niedoskonałość innymi zaletami. Odznaczają się krótkim czasem detekcji i analizy, zwłaszcza, że nie wymagają uprzedniego przygotowania próbki, które w metodach konwencjonalnych jest pracochłonne oraz miniaturowymi rozmiarami i możliwością użycia w każdym miejscu, również poza laboratorium. Ponadto, biosensory mogą być wykorzystywane wielokrotnie do wykonywania setek pomiarów.
Niewątpliwie, na podstawie przedstawionych rozwiązań można zaobserwować, że integracja nanostruktur z układami biologicznymi pozwala uzyskać nową jakość testów wykrywających mikroorganizmy, których czułość jest zadowalająca, a specyficzność oraz szybkość i niezawodność analizy czyni te urządzenia obiecującym narzędziem w diagnostyce mikrobiologicznej.
Piśmiennictwo
1. Schlegel HG. Mikrobiologia ogólna. 2008.
2. Lazcka O, Campo FJ Del, Munoz FX. Pathogen detection: A perspective of traditional methods and biosensors. Biosens Bioelectron. 2007;22(7):1205–17.
3. Kołwzan B. Zastosowanie czujników biologicznych (biosensorów) do oceny jakości wody. Ochr Sr. 2009;31(4):3–14.
4. Harper A, Anderson MR. Electrochemical glucose sensors-developments using electrostatic assembly and carbon nanotubes for biosensor construction. Sensors. 2010;10(9):8248–74.
5. R.K. Murray, D.K. Granner VWR. Ilustrowana biochemia Harpera 2008.pdf.
6. Koyun A, Ahlatcıoğlu E, İpek YK. Biosensors and Their Principles. A Roadmap Biomed Eng Milestones [Internet]. 2012;117–42. Available from: http://cdn.intechopen.com/pdfs/37345/InTech-Biosensors_and_their_principles.pdf 7. Saleem M. Biosensors a promising future in measurements. IOP Conf Ser Mater Sci Eng [Internet]. 2013;51:012012. Available from: http://stacks.iop.org/1757-899X/51/i=1/a=012012?key=crossref.70d0a1d6e5d86008e9479a99baf84250
8. Matejczyk M. Potencja£ aplikacyjny biosensorów mikrobiologicznych. 2010;297–304.
9. Ziółkowski R. Rozprawa Doktorska. Vol. 41, Rozprawa doktorska. 2012.
10. Sankiewicz A, Puzan B, Gorodkiewicz E, Elektrochemii Z, Chemii I. Bioczujniki SPRI – narzędzie diagnostyczne przyszłości. 2014;(6).
11. Kłos-Witkowska A. Ewolucja i rozwój biosensorów – problemy i perspektywy. 2014;60(12):1178–80.
12. Vashist SK, Venkatesh AG, Mitsakakis K, Czilwik G, Roth G, von Stetten F, et al. Nanotechnology-Based Biosensors and Diagnostics: Technology Push versus Industrial/Healthcare Requirements. Bionanoscience. 2012;2(3):115–26.
13. Berkenpas E, Millard P, Pereira da Cunha M. Detection of Escherichia coli O157:H7 with langasite pure shear horizontal surface acoustic wave sensors. Biosens Bioelectron. 2006;21(12):2255–62.
14. Wang J. Carbon-nanotube based electrochemical biosensors: A review. Electroanalysis. 2005;17(1):7–14.
15. Chen RJ, Bangsaruntip S, Drouvalakis K a, Kam NWS, Shim M, Li Y, et al. Noncovalent functionalization of carbon nanotubes for highly specific electronic biosensors. Proc Natl Acad Sci U S A. 2003;100(9):4984–9.
16. Yamada K, Choi W, Lee I, Cho BK, Jun S. Rapid detection of multiple foodborne pathogens using a nanoparticle-functionalized multi-junction biosensor. Biosens Bioelectron [Internet]. Elsevier; 2016;77:137–43. Available from: http://dx.doi.org/10.1016/j.bios.2015.09.030
17. Shao Y, Wang J, Wu H, Liu J, Aksay IA, Lin Y. Graphene based electrochemical sensors and biosensors: A review. Electroanalysis. 2010;22(10):1027–36.
18. Approved F, Security R. Report documentation page. 2009;298(0704).
19. Langer K, Barczyński P, Baksalary K, Filipiak M, Golczak S, Langer JJ. A fast and sensitive continuous flow nanobiodetector based on polyaniline nanofibrils. Microchim Acta. 2007;159(1-2):201–6.
20. Chou SY, Krauss PR, Renstrom PJ. Nanoimprint lithography. J Vac Sci Technol B Microelectron Nanom Struct [Internet]. 1996;14(6):4129. Available from: http://scitation.aip.org/content/avs/journal/jvstb/14/6/10.1116/1.588605
21. So HM, Park DW, Jeon EK, Kim YH, Kim BS, Lee CK, et al. Detection and titer estimation of Escherichia coli using aptamer-functionalized single-walled carbon-nanotube field-effect transistors. Small. 2008;4(2):197–201.
22. Qi P, Zhang D, Zeng Y, Wan Y. Biosynthesis of CdS nanoparticles: A fluorescent sensor for sulfate-reducing bacteria detection. Talanta. 2016;147:142–6.
23. Halkare P, Punjabi N, Wangchuk J, Kondabagil K, Mukherji S. Detection of bacteria using bacteriophage with hollow gold nanostructures immobilized fiber optic sensor. 2016;9899:98992Z. Available from:
http://proceedings.spiedigitallibrary.org/proceeding.aspx?doi=10.1117/12.2230639

