Autor: Aleksandra Kisiel
Około 75% pierwiastkowego składu wszechświata stanowi najprostszy ze wszystkich – wodór (Schramm, 1996) zawierający w swoim jądrze atomowym jeden proton oraz jeden neutron. Nie posiada on żadnego smaku ani zapachu natomiast z powietrzem lub czystym tlenem tworzy mieszaninę wybuchową, inaczej zwaną piorunującą (Burek, 1998).
Dzięki tej właściwości, oprócz zastosowania wodoru w przemyśle spożywczym, chemicznym czy metalurgicznym, powszechnie zaczęto go używać do produkcji paliwa. W stosunku do swojej masy ma on bardzo niskie ciepło spalania (141,9 MJ/kg) oraz ogromną wartość opałową równą 120 MJ/kg. Z wyżej wymienionych powodów, pierwiastek ten stał się podstawowym składnikiem mieszanin spalinowych do silników rakietowych, a współcześnie zaczyna podbijać rynek motoryzacyjny (Rand, 2008).
W 1970 roku General Motors jako pierwsi użyli sformułowania ”ekonomia wodoru”, które niesie informacje o pozytywnych aspektach ekologicznych oraz ekonomicznych wykorzystania tego pierwiastka jako źródła energii (Jones, 1970).
Z biegiem czasu, coraz więcej państw zaczęło podpisywać, powstały w 1997 roku Protokół z Kioto, który mówi o ograniczeniu produkcji gazów cieplarnianych, w tym emisji CO2, co spowodowało wielkie zainteresowanie wdrożeniem wodoru do przemysłu spalinowego.
W związku z rozwojem cywilizacji potrzeba dostarczania energii nieustannie wzrasta. Mimo tak wysokiej zawartości wodoru we wszechświecie, nie istnieją jego naturalne złoża. Naukowcy poszukują więc najwydajniejszego sposobu otrzymywania tego silnie energetycznego pierwiastka, który będzie spełniać przede wszystkim wymogi ekonomiczne, takie jak niska cena i prosta konstrukcja niezbędnych urządzeń oraz wysoka wydajność procesu syntezy. Schemat metod produkcji wodoru przedstawiono na Rys. 1.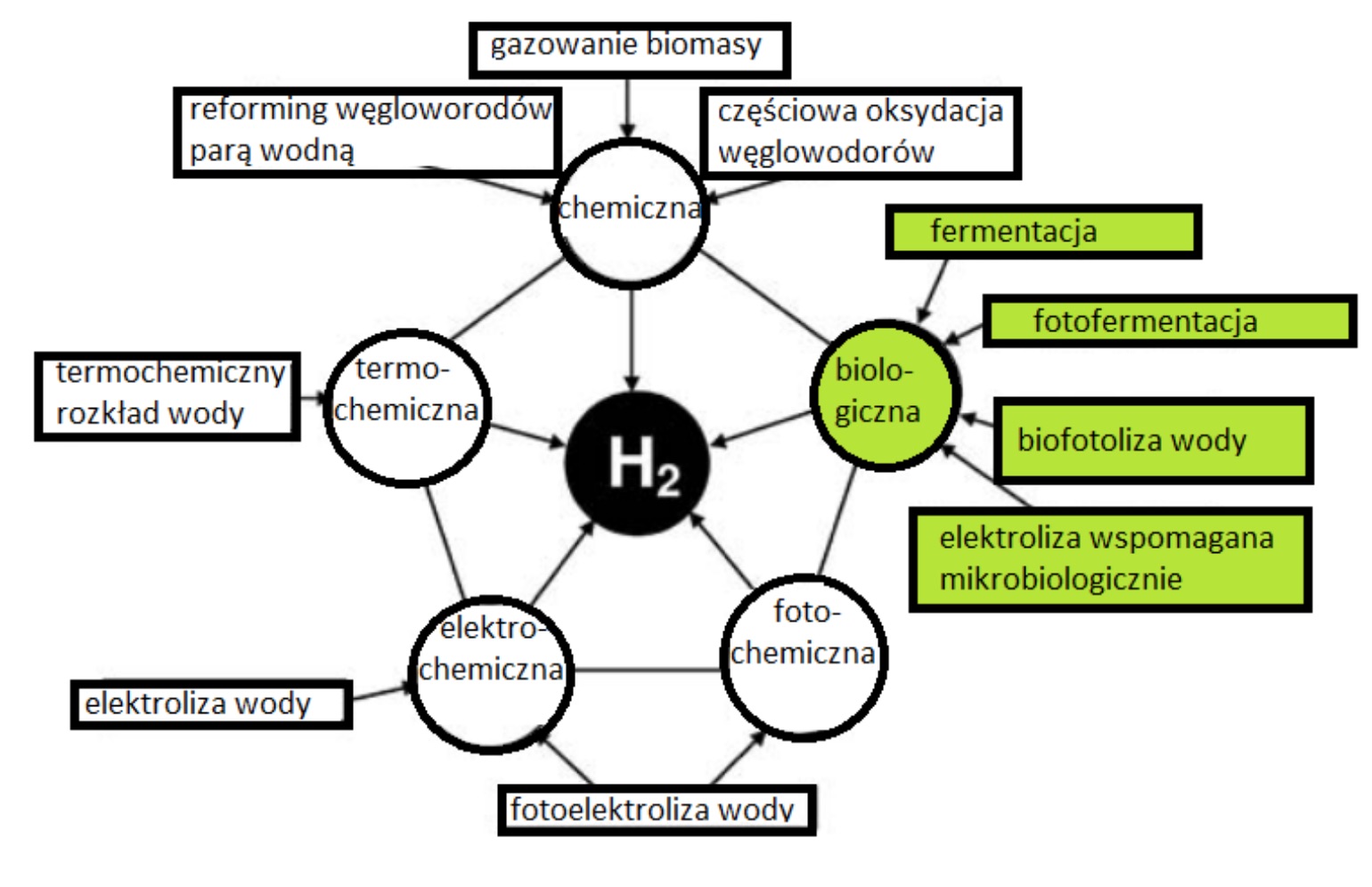
Rys. 1. Metody pozyskiwania wodoru (Moritz, 2012).
Chociaż wodór przemysłowy możemy otrzymać z wody, węglowodorów, a nawet biomasy to obecnie najwięcej, bo aż 48% jego produkcji opiera się na reformingu metanu z użyciem pary wodnej, 30% pochodzi z rafinowania ropy naftowej, 18% wydziela się podczas przemian węgla, np. w metodzie Habera-Boscha, a tylko 4% to produkty elektrolizy wody (Venkata i Pandey, 2013).
W 2013 roku przybliżona wartość rynku produkcji wodoru wynosiła aż 100 miliardów dolarów (Barlow, 2013).
Jego znaczenie jako źródła energii z roku na rok wzrasta. Najpopularniejsze sposoby otrzymywania wodoru opierają się jeszcze niestety głównie na wyczerpywalnych złożach, takich jak ropa naftowa. Dodatkowo, paliwa kopalne powodują zwiększanie się globalnego ocieplenia poprzez emisję gazów cieplarnianych. W tym momencie odzywa się biotechnologia, proponując rozwiązania zarówno ekonomiczne jak i ekologiczne. Produkcja wodoru przez mikroorganizmy, nazywana procesem biosyntezy, może stać się krokiem milowym w dziedzinie motoryzacji oraz ochronie środowiska.
Skąd bierze się biowodór? Metody otrzymywania
Jak wiadomo, wodór jest jednym najbardziej wydajnych paliw, a jego spalanie powoduje powstanie jedynie pary wodnej, co korzystnie wpływa na ziemską atmosferę. Używając tego rodzaju źródła energii, ograniczamy emisję gazów cieplarnianych oraz ilość kwaśnych opadów (Kozłowski i in., 2016).
Jednak problemy natury ekologicznej nadal istnieją podczas samego procesu otrzymywania wodoru. Rozwiązaniem okazuje się biowodór. Przedrostek „bio” pochodzi od biologicznych metod produkcji tego gazu (Rögner, 2015).
Należy jednak wziąć poprawkę na ścisłą klasyfikację metod. Ten wysokoenergetyczny gaz będzie również powstawał w procesach zgazowania biomasy oraz konwersji biogazu, które opierają się na procesach chemicznych. W bioprocesach biorą udział mikroorganizmy, więc do biologicznych metod syntezy wodoru ożemy zaliczyć te dwa wyżej wymienione chemiczne sposoby ze względu na aktywność bakteryjną w nieuniknionych etapach powstawania samych substratów dla ekologicznego paliwa. Synteza wodoru metodami biodegradacji oraz biotransformacji polega zwykle na użyciu bakterii beztlenowych, bakterii fotosyntezujących itd., w celu przemiany materiału organicznego w gaz. Jeśli tą organiczną degradację ścieków lub innych biomateriałów można prowadzić celem uzyskania energii, osiągamy podwójny sukces. Całość procesu jest całkowicie zgodna z zasadami ochrony środowiska oraz recyklingu, a dodatkowo może być wydajna ekonomicznie (Das i Vezoroglu, 2001).
Biosynteza H2 zachodzi w różnego rodzaju przemianach biochemicznych, w przypadku których możemy mówić o odnawialnych źródłach energii. Odnawialnych, zatem niekończących się i przynoszących dużo więcej korzyści niż strat. Z tych właśnie powodów biotechnologowie obecnie skupiają się nad zwiększeniem wydajności syntezy biowodoru.
Zgazowanie biomasy ciągnie za sobą konieczność rozdziału wodoru od pozostałych produktów powstałych w reakcji, użycia katalizatorów oraz wysokiego ciśnienia czy temperatury. W procesie elektrolizy wody powstaje wodór o wysokiej czystości, jednak metoda ta jest dość wymagająca energetycznie, co za tym idzie, bardzo kosztowna i nieopłacalna (Levin i Chahine, 2010).
Użycie bakterii w celu syntezy wodoru może rozwiązać problemy natury ekologicznej oraz ekonomicznej, pozwalając tanio i szybko wyprodukować H2 o wysokiej czystości. Warunki, które są konieczne do przebiegu syntezy tego gazu przez mikroorganizmy nie są zbyt wygórowane. Optymalna jest najczęściej temperatura pokojowa oraz naturalnie występujące ciśnienie atmosferyczne, a dodatkowo warunki wodne. Dotychczas poznane metody syntezy biowodoru to między innymi: bezpośrednia fotoliza wody przy użyciu cyjanobakterii lub alg, rozkład związków organicznych z wykorzystaniem bezsiarkowych bakterii purpurowych, fermentacja czy procesy bioelektrochemiczne, takie jak bioelektroliza (Das i Veziroglu, 2008).
Stosuje się również połączenia hybrydowe wyżej wymienionych sposobów. Największe predyspozycje ekonomiczne wykazują metody biologiczne takie jak: biofotoliza czy ciemna fermentacja oraz zastosowanie sprzężonych razem ciemnej i fotofermentacji (Adams i Stiefel, 1998).
Na Rys. 2 przedstawiono podział biologicznych metod produkcji H2.
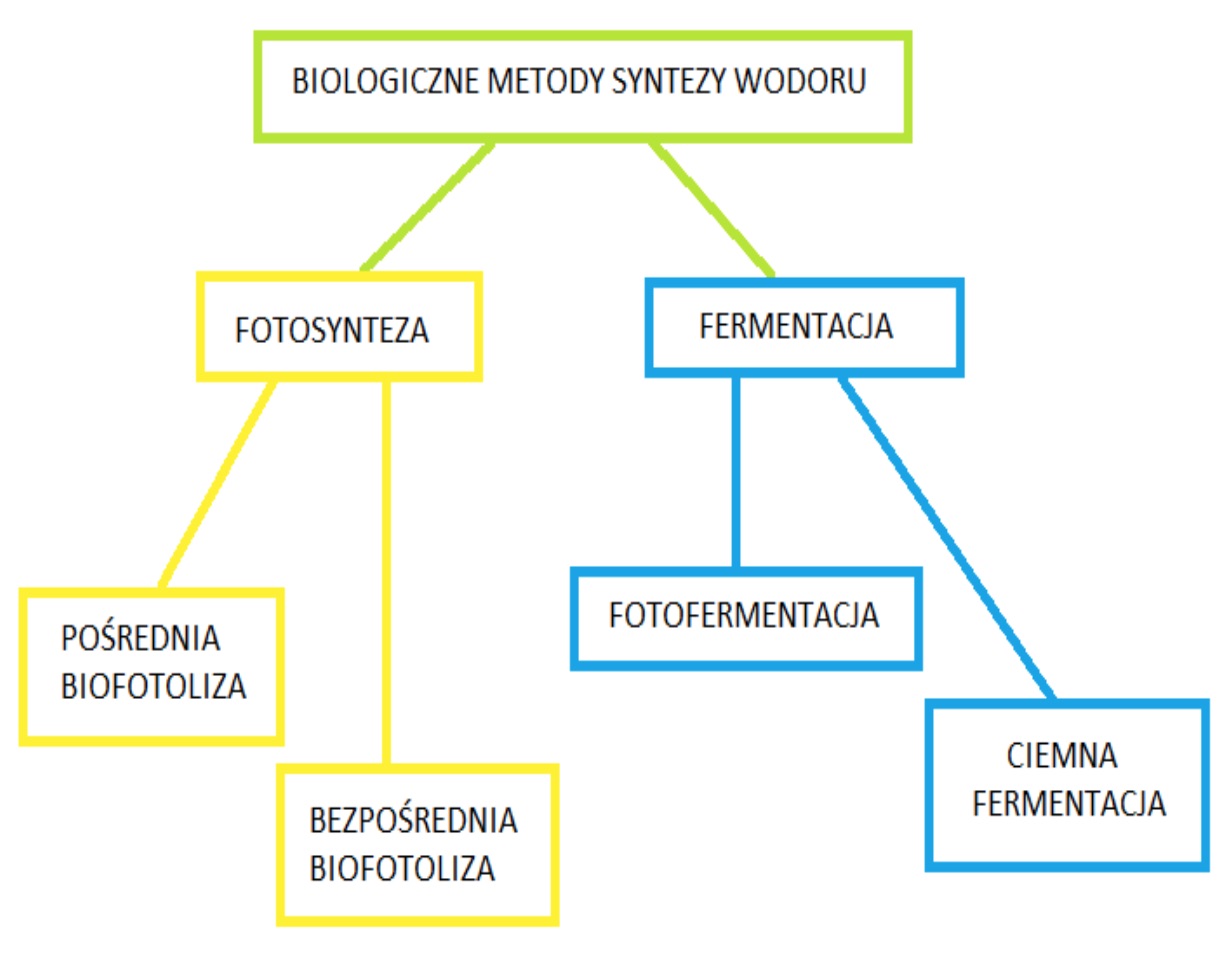
Rys. 2. Biologiczne metody syntezy wodoru (Saifuddi, 2016).
Spośród powyższych metod w pracy zostaną opisane: fermentacja prowadzona przez bakterie anaerobowe, fotofermentacja z użyciem nitrogenazy oraz proces przemiany biomasy, który reprezentuje najwięcej walorów ekologicznych.
Historia biowodoru
Biowodorowa rewolucja zaczęła się już w 1939 roku kiedy Hans Gaffron zauważył, że Chlamydomonas reinhardtii (zielony fotosyntezujący glon) potrafi syntezować H2. W tamtym czasie zarówno on, jak i wielu innych naukowców zajęło się badaniem tego procesu. Nie zdołali oni jednak poznać mechanizmu syntezy wodoru podczas fotosyntezy prowadzonej przez glon. Przełomowe okazały się badania Anastosiosa Melisa, który na koniec XX wieku zaobserwował wpływ siarki na ten proces. Okazało się, że alga pozbawiona dostępu do tego pierwiastka przekierowuje produkcję tlenu w procesie normalnej fotosyntezy na syntezę wodoru. Kluczowy element stanowi tutaj pewien enzym, zwany hydrogenazą. Jak wiadomo hydrogenaza, ulega dezaktywacji w obecności tlenu. Melis dowiódł, że w momencie wyczerpania siarki, glon Chlamydomonas reinhardtii traci możliwość wewnętrznego przepływu tlenu, co stwarza idealne warunki do funkcjonowania powyższego enzymu. A to z kolei prowadzi do otrzymywania wodoru jako produktu samożywnego odżywiania się tego organizmu. Obecnie trwają badania nad wykazaniem tej samej funkcji u glonów Chlamydomonas moewusii (Melis i Happe, 2001).
Organizmy wykorzystywane do syntezy biowodoru
Obecnie biowodór może być syntezowany w przemianach chemicznych takich jak: gazowanie biomasy, konwersja biogazu, podczas różnych fermentacji prowadzonych przez Clostridium acetobutilicum, Clostridium butyricum, Rhodobacter sphaeroides, Enterobacter cloacae, Enterobacter aerogenes, oraz podczas fotosyntezy z użyciem hydrogenazy, w przypadku glonu Chlamydomonas reinhardtii. Powyższe bakterie są zróżnicowane pod względem wymagań, morfologii czy metabolizmu. Natomiast wśród metod biochemicznych, podczas których powstaje H2 z udziałem tych organizmów, należy wymienić przede wszystkim fotofermentację (u bakterii purpurowych) oraz ciemną fermentację (Hallenbeck, 2009).
Immobilizowane Clostridium butyricum wytwarzają 2 mole H2/mol glukozy już przy 50% wydajności. Enterobactericiae wydzielają H2 z podobną wydajnością, rozkładając różne monosacharydy. Wśród metylotrofów, metanogenów, bakterii żwacza i ciepłolubnych archeonów, najbardziej obiecujące wyniki wykazuje Ruminococcus albus (2,37 mole wodoru/mol glukozy). Inne warte uwagi przykłady to: immobilizowany anaerob Bacillus licheniformis – 0,7 mola H2/mol glukozy oraz przeprowadzający fotosyntezę Rhodospirillum rubrum – nawet 6 moli wodoru pochodzącego z rozkładu octanu, bursztynianu lub jabłczanu. Również Cellulomonas, ściśle współżyjąca z mutantem Rhyzobium capsulata, wykazuje bardzo wysoką wydajność syntezy biowodoru (6,2 mola H2/mol glukozy) w hodowli na celulozie. Pod kątem syntezy wodoru z użyciem światła zostały przebadane też Cyanobacteria, a dokładnie Anabaena, Synechococcus i Oscillatoria sp.
Zwiększoną syntezę wodoru wykryto u mutanta Hup Anabaena variabilis, a Synechococcus sp. posiada duży potencjał do produkcji H2 w fermentorach oraz kulturach zewnętrznych. Ilość oraz różnorodność powyższych mikroorganizmów pokazuje, że synteza biowodoru może być bardzo przyszłościową metodą pozyskiwania alternatywnej energii. Oczywiście również wyczerpywanie się zapasów paliw kopalnych oraz pogarszający się stan zanieczyszczenia środowiska, zwiększają zainteresowanie tym tematem (Nandi i Sengupta, 2015).
Na Rys. 3 zobrazowano schematyczny podział organizmów żywych, które są potencjalnie zdolne do przemysłowej produkcji biowodoru.
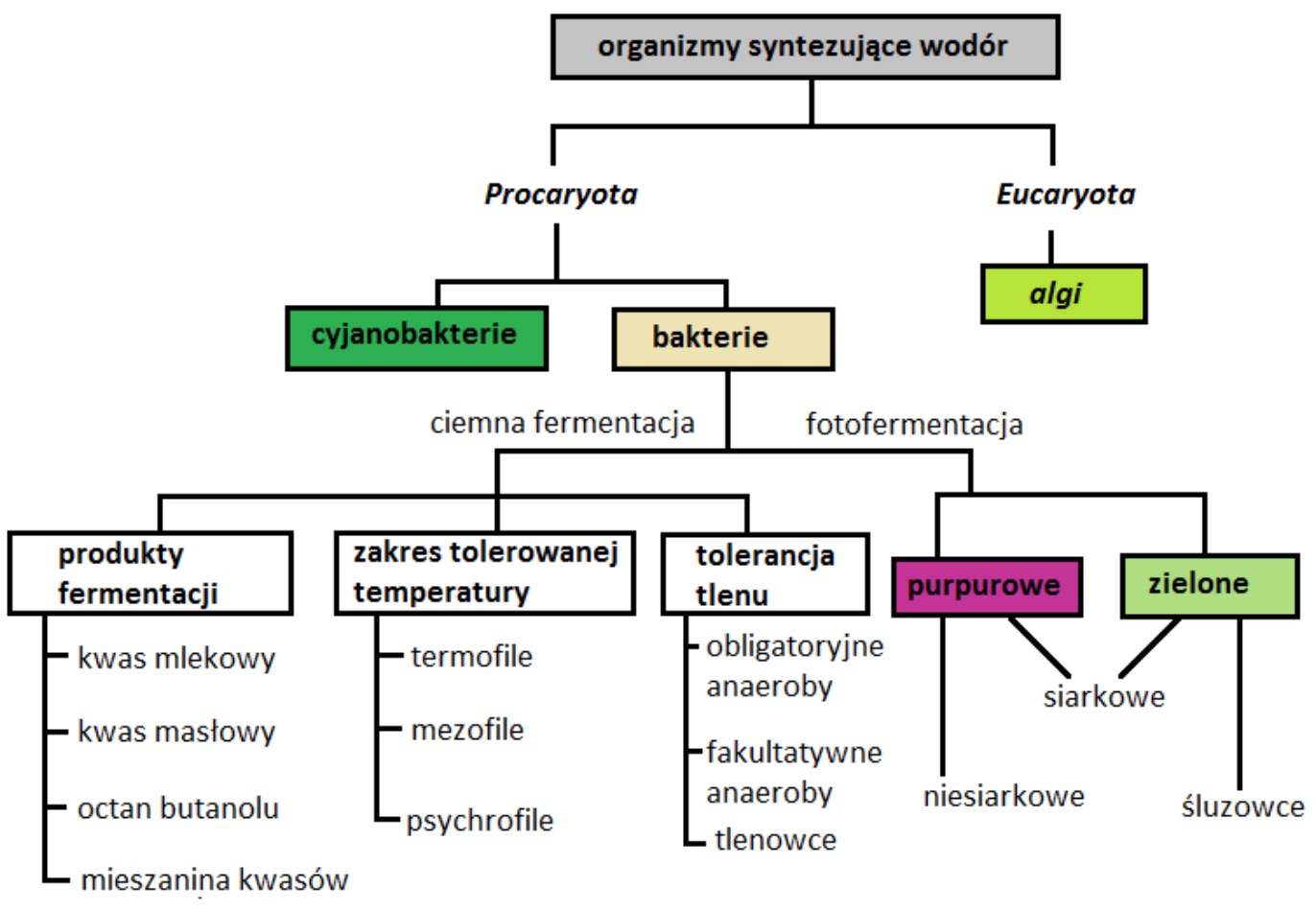
Rys. 3. Schematyczny podział organizmów syntezujących wodór (Chandrasekhar i in., 2015).
Oprócz szerokiego spektrum gatunków bakterii, również algi mogą stanowić podstawowy element przy syntezie biologicznego wodoru. Glony mogą być wykorzystywane na kilka sposobów, jeśli chodzi o pozyskiwanie alternatywnych źródeł energii. Dzięki swojej zdolności do akumulacji lipidów stosowane są do produkcji biodiesla, natomiast w procesie powstawania biowodoru stanowią biomasę, którą następnie można obrabiać wcześniej wymienionymi sposobami, z odzyskaniem dużej ilości energii (Guan i in., 2004).
Glony wykorzystują również proces bezpośredniej biofotolizy, która polega na wydzielaniu się H2 z wody, podczas fotosyntezy, gdzie energia świetlna rozbija cząsteczkę wody na wodór i tlen. Istotne dla badań w tej dziedzinie są przeważnie jednokomórkowe mikroglony, które muszą wykazywać enzymatyczne i metaboliczne przystosowania do produkcji wodoru. Najczęściej stosowany jest Chlamydomonas reinhardti, żyjący w glebie i słodkich wodach, Platymonas subcordiformis oraz glony z gatunku Chlorella. Oczywiście kierunek wszelkim dziedzinom biotechnologicznym, jak i również produkcji biowodoru przez powyższe mikroorganizmy, nadaje inżynieria genetyczna, dzięki której tworzy się specjalnie dostosowane do optymalnie wydajnego procesu syntezy mutanty lub konstrukty genetyczne (Dudek i in., 2014).
Ciemna fermentacja u bakterii anaerobowych
Fermentacja to słowo pochodzące z łaciny, opisujące procesy enzymatyczne, podczas których zachodzi stopniowy rozkład związków organicznych. Ważnym warunkiem fermentacji jest brak tlenu. Podczas tego beztlenowego procesu zachodzą różne reakcje oksydoredukcyjne, w których jest dostarczana energia w postaci ATP (tzw. fosforylacja substratowa).
Fermentacje powszechnie prowadzą różne organizmy, np. drobnoustroje fermentują szeroki zakres różnorodnych związków organicznych, m.in. sacharydów, aminokwasów czy związków heterocyklicznych, natomiast rośliny lub zwierzęta rozkładają w podobny sposób głównie glukozę. Najlepiej poznana jest fermentacja węglowodanów, która przebiega nieco inaczej u poszczególnych gatunków, chociaż czasem związki pośrednie czy etapy procesu np. glikoliza, są jednakowe. Obserwuje się natomiast powstawanie rozmaitych końcowych produktów fermentacji. Mogą to być kwasy, np.: octowy, mlekowy, masłowy, lub alkohole, np.: etylowy, butylowy czy glicerol, a również acetonina, glikol butylenowy oraz wodór. Pierwotnie, w czasach beztlenowej atmosfery ziemskiej, procesy fermentacyjne były wykorzystywane przez organizmy do syntezy energii. Obecnie przy wykorzystaniu drobnoustrojów prowadzi się fermentację alkoholową, mlekową czy octową (mimo, że jest to proces tlenowy, tradycyjnie nosi nazwę fermentacji) na skalę przemysłową, zaspokajając przede wszystkim przemysł spożywczy poprzez powstające w procesie produkty (Daintith, 2008).
W poprzednim rozdziale podzielono mikroorganizmy zdolne do syntezy biowodoru. Najczęściej stosowane bakterie anaerobowe wykorzystujące proces ciemnej fermentacji to szczepy bakterii Clostridium pasteurianum oraz Enterobacter cloacae. Clostriudium zostały odkryte w 1890 roku przez rosyjskiego mikrobiologa, Sergieja Winogradskiego. Był to pierwszy skatalogowany niesymbiotyczny mikroorganizm, zdolny do przyswajania azotu atmosferycznego (Dworkin i Gutnick, 2012).
Clostridium pasteurianum jest mezofilem, który wykazuje umiejętność do przekształcania węglowodorów w aceton, maślany, ditlenek węgla oraz nadający się na paliwo przyszłości – wodór, powstający w procesie ciemnej fermentacji (Hamilton, 2015).
Enterobacter cloacae natomiast jest fakultatywnym beztlenowcem, zaliczanym do bakterii Gram-ujemnych. Przyjmuje kształt pałeczki i posiada obwodowe wici. Podobnie do Clostridium, również preferuje warunki mezofilne. Jest stosowany do bioreaktorowego unieszkodliwiania materiałów wybuchowych, biokontroli roślin oraz produkcji wodoru (Pudge i in., 2003).
Rys. 4. Enterobacter cloacae na płytce z podłożem agarowym (en.wikipedia.org/wiki/Enterobacter_cloacae).

Rys. 5. Enterobacter cloacae obraz z pod mikroskopu świetlnego (x1000) (www.bacteriainphotos.com/Enterobacter%20cloacae%20light%20microscopy.html).
Proces ciemnej fermentacji u bakterii anaerobowych
Wodór powstaje podczas różnych reakcji biochemicznych. Na przykład w procesie fermentacji metanowej jest produktem pośrednim, którego jednak nie można wykorzystać jako źródła energii, ponieważ jest on od razu zużywany przez bakterie metanogenne. Przy udziale innych mikroorganizmów może zajść natomiast proces fotofermentacji lub fermentacji ciemnej, gdzie wodór będzie produktem końcowym.
Ciemna fermentacja wodorowa to przemiana cukrów prostych do H2, ditlenku węgla oraz etanolu lub kwasów organicznych (najczęściej octowego, mlekowego czy masłowego). Jest jednak istotna kwestia, która znacząco wyróżnia tę metodę syntezy wysokoenergetycznego gazu. Chodzi o proces degradacji polisacharydów do monocukrów, który prowadzony jest przed właściwą fermentacją na drodze hydrolizy enzymatycznej lub z wykorzystaniem metod fizyko-chemicznych. Skrócony zapis reakcji chemicznej przebiegającej podczas tej biologicznej metody syntezy biowodoru zamieszczono poniżej. Substratem jest tu cukier prosty – glukoza, a produktami, oprócz cennego wodoru, są kwas octowy i tlenek węgla (IV).C6H12O6 + 2 H2O → 4 H2 + 2 CH3COOH + 2 CO2
(Orlygsson, 2010).
Ciemna fermentacja wodorowa wydaje się być obecnie jedną z najbardziej rozpowszechnionych i obiecujących biologicznych metod syntezy wodoru. Cechuje się ona wysoką wydajnością syntezy pożądanego w przemyśle energetycznym gazu. Podczas dotychczasowych badań skupiano się głównie na czystych kulturach utrzymywanych w warunkach mezofilnych, czasem wykraczających w stronę wyższych temperatur. Istnieje jednak szerokie spektrum użycia ciemnej fermentacji wodorowej ze względu na możliwość zastosowania jako substratów ścieków lub odpadów stałych. Stwierdzono, że w tym przypadku dużo korzystniejsze jest używanie mieszanych kultur drobnoustrojów (Liu i in., 2008).
Metoda ciemnej fermentacji (wykorzystująca węglowodany takie jak glikogen czy skrobia) może stać się przyczyną eliminacji fotobioreaktorów, które wykazują ograniczenia już na etapie przepuszczalności światła. Synteza wodoru podczas ciemnej fermentacji jest szybsza od innych technik biologicznych produkcji tego gazu. W procesie tym, oprócz wymienionych wyżej odpadów, można wykorzystać również biomasę glonów. Stosowane tu mikroorganizmy takie jak bakterie beztlenowe oraz niektóre zielenice wykazują optimum temperaturowe w zakresie od 30˚C do 80˚, żyjąc w warunkach pozbawionych światła. Ilość powstałego podczas fermentacji wodoru zależy również od wartości pH, HRT (hydraulicznego czasu retencji) oraz ciśnienia. Dla uzyskania optymalnej produkcji H2 zalecana jest wartość pH na poziomie 5-6 (Krzemińska i Kwietniewska, 2011).
Fotofermentacja z użyciem nitrogenazy
Fotofermentacja polega na fermentatywnym rozkładzie organicznych substratów wprost do wodoru, za co odpowiedzialne są różnorodne mikroorganizmy fotosyntezujące. Należą do nich przede wszystkim beztlenowe bakterie purpurowe i zielone. W odróżnieniu od roślin, donorem elektronów podczas fotosyntezy nie jest w tym wypadku woda, a produktem końcowym tlen – stąd nazwa – fotosynteza anoksygenowa (Sikora, 2008).
W warunkach świetlnych, purpurowe bakterie niesiarkowe, w tym gatunki Rhodobacter, wykorzystują w tym celu kwasy organiczne, takie jak octan, mleczan i maślan, a purpurowe bakterie siarkowe – zredukowane związki siarki. Natomiast produktem fotosyntezy beztlenowej bakterii zielonych i purpurowych jest wodór cząsteczkowy (Rupprecht i in., 2008).
Fotofermentacja to inaczej konwersja energii świetlnej, która pochłaniana jest na błonach bakteryjnych poprzez wbudowane w nie barwniki absorbujące oraz przekazywana przez transbłonowe białka jako siła protomotoryczna, w związku z czym powstaje ATP. Elektrony trafiają na ferredosynę oraz na NAD+, gdzie wytwarzana jest siła redukująca, czyli NADH. Ważną kwestią jest fakt, iż bakterie te wychwytują energię słoneczną, aby przekształcić ją w gazowe paliwo z zastosowaniem nitrogenaz jedynie przy braku obecności jonów amonowych (NH4+) (Venkata i Pandey, 2013).
Na Rys. 6 zilustrowano modelowy schemat przebiegu fotofermentacji, gdzie ATP powstaje po przekonwertowaniu energii świetlnej pochłanianej przez purpurowe bakterie bezsiarkowe.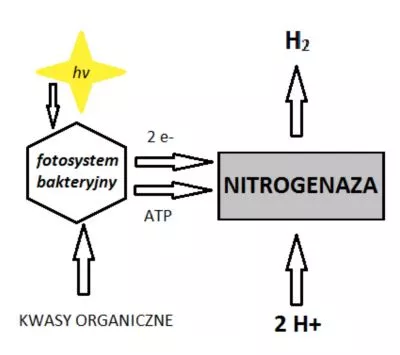
Rys. 6. Schemat przebiegu fotofermentacji (Szewczyk, 2008).
Bakterie, które syntetyzują wodór w procesie fotofermentacji to głównie bezsiarkowe Rhodospirillaceae, a spośród nich rodzaje Rhodopseudomonas, Rhodospirillum, Rhodobacter oraz Rhodobium. Dość często badanym gatunkiem jest Rhodospirillum rubrum, który wykazuje unikatową aktywność nitrogenazy, redukującej zarówno azot cząsteczkowy jak i protony do wodoru cząsteczkowego. Inne bakterie bezsiarkowe również posiadają ten enzym, który nie różni się niczym od nitrogenaz sinic. Podobnie jak u sinic nitrogenazie towarzyszy hydrogenaza, jednak wykazano, że mutanty bez jej obecności potrafią syntezować o wiele więcej wodoru (Sikora, 2008).
Do mikroorganizmów syntezujących biowodór w procesie fotofermentacji z użyciem hydrogenazy zaliczymy również purpurowe bakterie siarkowe, które są ścisłymi beztlenowcami np. Allochromatium vinosum, Thiocapsa roseopersicina, Chlorobium vibloroforme, Desulfuromonas acetoxidans oraz Chloroflexus aurantiacus. Zakres pochłanianych przez nie fal promieniowania elektromagnetycznego zamyka się w przedziale od 400 do 950 nm (Chandrasekhar i in., 2015).
Na Rys. 7 pokazano zdjęcie spod mikroskopu przedstawiające komórki sztandarowego przykładu organizmu wykorzystywanego w procesie fotofermentacji, tj. Rhodospirillum rubrum.
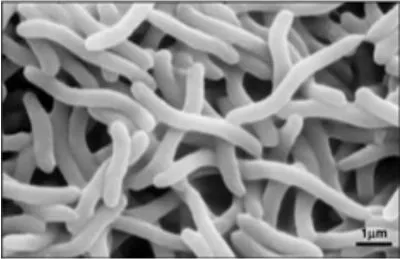
Rys 7. Zdjęcie komórek Rhodospirillum rubrum z pod skaningowego mikroskopu elektronywego – SEM (microbewiki.kenyon.edu/index.php/File:Rrub2.jpg).
Rhodospirillum rubrum zalicza się do mezofilii, a jego optimum temperaturowe to 25-30˚C. Posiada polarnie rozmieszczone wici oraz jest fakultatywnym beztlenowcem. W zależności od obecności tlenu może prowadzić procesy fermentacji alkoholowej lub oddychania tlenowego. Jest także zdolny do fotosyntezy, ponieważ zawiera karotenoidy i bakteriochlorofil. Absorbują one światło i przekształcają je w energię, a także nadają jej wyraźny fioletowo-czerwony kolor w warunkach beztlenowych. Rhodospirillum rubrum w obecności tlenu jest bezbarwny. Poza zdolnością do wiązania ditlenku węgla, wykazuje zdolność do wiązania azotu. Zawiera zarówno Fe-Mo- (żelazowo-molibdenową), jak i Fe-nitrogenazę. Mikroorganizmy z tego rodzaju są obecnie jednymi z najbardziej rokujących na polu badań nad syntezą biowodoru metodą fotofermentacji (Najafpour i in., 2004).
Zaletą fotofermentacji jest fakt, że powstający wodór jest względnie czysty (zawiera domieszkę 10-20% ditlenku węgla) i po dość łatwej obróbce może być bezpośrednio zużywany w ogniwie paliwowym. Stanowi to ogromny plus tej metody, ponieważ eliminuje przymus wymagającego energetycznie i czasowo procesu oczyszczania pozyskanego gazu. Z tego powodu fotofermentacja z użyciem nitrogenazy wzbudza spore zainteresowanie wśród badaczy i praktyków, zajmujących się syntezą biowodoru (Urbaniec i Grabarczyk, 2005).
Niestety oprócz tej zalety istnieją również wady procesu fotofermentacji, które wynikają z właściwości samych nitrogenaz. Chodzi tu o ich stosunkowo niewielką aktywność katalityczną oraz zjawisko natychmiastowego tłumienie ich ekspresji przez występowanie NH4+ w środowisku reakcji (Brentner i in., 2010).
Te dwa fakty spowodowały prowadzenie licznych badań nad optymalizacją procesu fotofermentacji. Aby zwiększyć wydajność oraz ekonomię produkcji biowodoru tą metodą, biotechnolodzy stosują obecnie modyfikacje genetyczne mikroorganizmów, inżynierię metaboliczną, poprawę konstrukcji reaktora czy zastosowanie różnorodnych złóż do immobilizacji komórek (Demirbas, 2009).
Niestety nadal nie udało się osiągnąć zadowalających efektów, a produkcja biowodoru, szczególnie metodą fotofermentacji, pozostaje ciekawostką i jak na razie niezbyt obiecującą alternatywą produkcji energii na skalę przemysłową.
Biomasa oraz zalety jej stosowania do produkcji wodoru
W związku ze wspomnianym wcześniej Protokołem z Kioto, w przemyśle coraz większe znaczenie zaczynają odgrywać ekologiczne sposoby wytwarzania energii oraz przerobu materii organicznej. Jedną z bardziej interesujących metod pozyskiwania biowodoru, jako alternatywnego źródła energii, są opisane w poprzednich rozdziałach, fermentacje: świetlna oraz ciemna, szczególnie sprżężone razem. Kolejnym wydajnym sposobem na syntezę tego wysokoenergetycznego gazu jest przeróbka biomasy. Biomasa jest to termin ogólny, który określa materiał organiczny, powstający podczas fotosyntezy roślin zielonych, w tym glonów, drzew czy upraw (McKendry, 2002).
Wykorzystanie biomasy do produkcji wodoru jest wysoce opłacalne, z racji stosowania jako surowca już istniejących pokładów materii organicznej. Ważnym aspektem jest również fakt utylizowania odpadów w procesach przekształcania biomasy, podczas których produkowana jest energia. Jako źródła biomasy używane są rośliny rolnicze (uprawy buraków cukrowych i roślin oleistych) odpady ligninoocelulozowe, takie jak drewno i odpady drzewne, rośliny wodne, takie jak algi i chwasty wodne, odpady przemysłowe lub komunalne oraz odpady zwierzęce (Nath i Das, 2003).
Warto zwrócić uwagę, że wiele odpadów przemysłu rolno-spożywczego zawiera skrobię lub celulozę. Złożony charakter tych węglowodanów może niekorzystnie wpływać na ich biodegradowalność. Skrobię hydrolizuje się do glukozy i maltozy za pomocą kwaśnej lub enzymatycznej hydrolizy, dalej przekształca się te węglowodany do kwasów organicznych, a następnie w gazowy wodór. Odpady rolnicze zawierające celulozę, wymagają bardziej rozbudowanej obróbki wstępnej. Powinny być one mielone, a przed fermentacją, poddawane delignifikacji za pomocą środków mechanicznych lub chemicznych (De Vrije i in., 2002).
Na Rys. 8 przedstawiono źródła pochodzenia biomasy oraz trzy typowe przykłady jej wykorzystania w przemyśle.
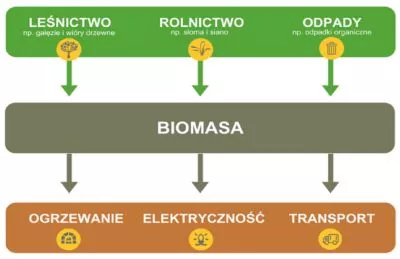
Rys. 8 Schemat obrazujący przykładowe źródła biomasy oraz możliwości jej zastosowania (tergopower.com/en/general-information-about-biomass).
Biomasę pochodzącą zarówno z odpadów komunalnych, masy algowej czy przemysłu stolarskiego można wykorzystać do produkcji szeroko rozumianej energii. Zaczynając od codziennego ogrzewania domów poprzez używanie kotłów do spalania biomasy, do produkcji metanu (biogazu) podczas procesów gnilnych, prowadzonych przez anaeroby w rozkładającej się materii organicznej. Biomasę można obrabiać różnymi sposobami i otrzymywać z niej również bioetanol lub biowodór. W związku z powyższym, kolejną zaletą używania biomasy jest bardzo szerokie spektrum produktów powstających w procesach jej przemian. Znajdują one zastosowanie w ogrzewaniu, zarówno w elektrowniach jak i ogrzewaniu centralnym, są stosowane jako paliwo czy używane do wytwarzania prądu, np. w ogniwach paliwowych. Najczęściej stosowanymi technikami biotechnologicznymi do przemiany biomasy w H2 są opisane wcześniej fotofermentacja oraz ciemna fermentacja.
Metody obróbki biomasy stosowane do syntezy wodoru
Procesy biologiczne wykorzystywane do produkcji wodoru z materiałów zawierających węgiel to głównie fermentacja ciemna oraz fotofermentacja. Podstawowe substraty wymagane w pierwszej z nich to cukry proste, np. glukoza lub disacharyd – sacharoza. Natomiast w procesie fotofermentacji najczęściej stosowane są kwasy organiczne, takie jak kwas octowy, kwas masłowy i kwas mlekowy. Działające osobno obie fermentacje nie przynoszą optymalnych efektów, dlatego dobrym rozwiązaniem okazało się połączenia tych dwóch metod. Jest to proces sekwencyjny, czyli prowadzone naprzemiennie ciemna i fotofermentacja. Najpierw cukry proste zostają przekształcane w kwasy organiczne podczas ciemnej fermentacji, a następnie produkty te są wykorzystywane jako substrat dla procesu fotofermentacji (Hidayet, 2016).
Podczas ciemnej fermentacji pożądanym produktem jest H2, zebrany w fazie gazowej. Istnieją jednak ciekłe produkty uboczne, które zawierają głównie kwasy organiczne (masłowy, octowy, mlekowy, mrówkowy itp.). Główną wadą pozostającego płynu pohodowlanego jest problem jego oczyszczania. Znalazł on jednak zastosowanie jako źródło węgla dla procesu fotofermentacji. Stąd optymalne stało się połączenie tych dwóch metod syntezy biowodoru.
Aby produkcja wodoru metodami biologicznymi stała się bardziej ekonomiczna oraz ekologiczna opracowano trzystopniowy, zintegrowany proces, w którym pierwszy etap polega na produkcji biomasy algowej przez Chlamydomonas reinhardtii. Następnie masa powstała z glonów (odpowiednik glukozy skrobiowej) jest stosowana jako surowiec do ciemnej fermentacji z udziałem Clostridium butyricum, który wytwarza z niej H2 i kwasy organiczne. W ostatnim etapie brzeczkę pofermentacyjną z zawartymi w niej kwasami stosuje się do fotofermentacji przy udziale Rhodobacter w celu wytworzenia wodoru z pozostałości organicznych płynu pohodowlanego.
Stwierdzono, że zielone algi absorbują światło widzialne promieniowania słonecznego, podczas gdy bakteria fotosyntetyczna absorbuje część podczerwonej części promieniowania słonecznego. Zatem użycie tych dwóch organizmów może zwiększyć ogólną wydajność konwersji światła. Najlepszym rozwiązaniem biologicznej syntezy wodoru okazało się hybrydowe połączenie dwóch fermentacji wykorzystujących biomasę, przy użyciu mikroorganizmów takich jak Chlamydomonas reinhardtii i Rhodospirillum rubrum. Taki zintegrowany system daje wysokowydajną produkcję stosunkowo czystego H2, a dodatkowo zapewnia tanie pozyskiwanie surowca drogą utylizacji nadprogramowych ilości odpadów biologicznych (Melis i Melnicki, 2006).
Przykładowe zastosowanie biowodoru
Ogniwa wodorowe
W obecnych czasach jednym z większych problemów globalnych jest nadmierna emisja gazów cieplarnianych oraz kończące się zasoby paliw kopalnych. Oprócz dobrowolnych działań świadomych ludzi, coraz częściej państwa narzucają ustawy, które wymagają kontroli produkowanych w przemyśle spalin i odpadów. Poszukiwane są rozwiązania produkcji energii elektrycznej bez potrzeby zanieczyszczania środowiska. Jednym z takich pomysłów są popularne dziś ogniwa wodorowe.
Wodorowe ogniwo paliwowe jest urządzeniem elektrochemicznym, które produkuje energię elektryczną bez udziału spalania, a jedynie przez łączenie wodoru i tlenu, przy czym produktami ubocznymi jest woda i ciepło. Cechą charakterystyczną tych urządzeń jest możliwość ciągłego dostarczania substratu i produkcji prądu w sposób nieprzerwany (Connihan, 1981). Proces zachodzący w ogniwach wodorowych polega na odwrotnej elektrolizie. Substraty podawane są w fazie gazowej.2 H2 + O2 → 2 H2O + energia
Początki rozwoju alkalicznych ogniw paliwowych sięgają lat 1930-1950, w których pracował nad nimi brytyjski inżynier, Francis Thomas Bacon. Opracowana przez niego technologia została udzielona na rzecz amerykańskiej firmy Pratt i Whitney, a następnie wykorzystano ją do ogniw paliwowych w statku kosmicznym Apollo.
W porównaniu do stosowanych powszechnie silników spalinowych, napędzanych benzyną lub innymi produktami pochodzącymi z reformingu ropy naftowej, ogniwa wodorowe nie produkują ditlenku węgla i nie zanieczyszczają środowiska. Posiadają również inne, warte uwagi zalety. Wśród nich są m.in. wysoka wydajność oraz bardzo cicha praca. Należy również podkreślić, że jeśli wodór jest produkowany z odnawialnych źródeł energii, np. z biomasy algowej podczas ciemnej fermentacji, to proces wytwarzania energii w ogniwach paliwowych jest czysto ekologiczny i praktycznie nie ma wad.
W ogniwie wodorowym zachodzą jednocześnie dwie reakcje: reakcja utleniania na anodzie i reakcja redukcji na katodzie. Składają się one na całkowitą reakcję redoks, tworzenie się wody z wodoru i tlenu. Uproszczony zapis reakcji został przedstawiony poniżej:Reakcja anodowa: H2 → 2 H+ + 2e-
Reakcja katodowa: 1/2 O2 + 2 e- + 2 H+ → H2O
Reakcja ogólna: H2 + 1/2 O2 → H2O
(Cook, 2011).
Podobnie jak w ogniwach galwanicznych znanych np. z baterii, anoda i katoda są oddzielone elektrolitem, który umożliwia przenoszenie jonów z jednej strony na drugą. Z lewej strony do ogniwa doprowadzany jest wodór oraz odprowadzana jest woda, jako produkt uboczny. Na anodzie cząsteczki H2 najpierw stykają się z katalizatorem, będącym metalem (nikiel, srebro, platyna) na powierzchni elektrody. Cząsteczki wodoru rozpadają się, łącząc się z powierzchnią platyny, tworząc słabe wiązania, np. H-Pt. Każdy atom uwalnia swój elektron, który przemieszcza się wokół obwodu zewnętrznego do katody. Na Rys. 9 zilustrowano schemat ogniwa wodorowego, gdzie z prawej strony podawany jest tlen, oddający elektrony na anodzie, co powoduje przepływ prądu zgodnie z ruchem wskazówek zegara.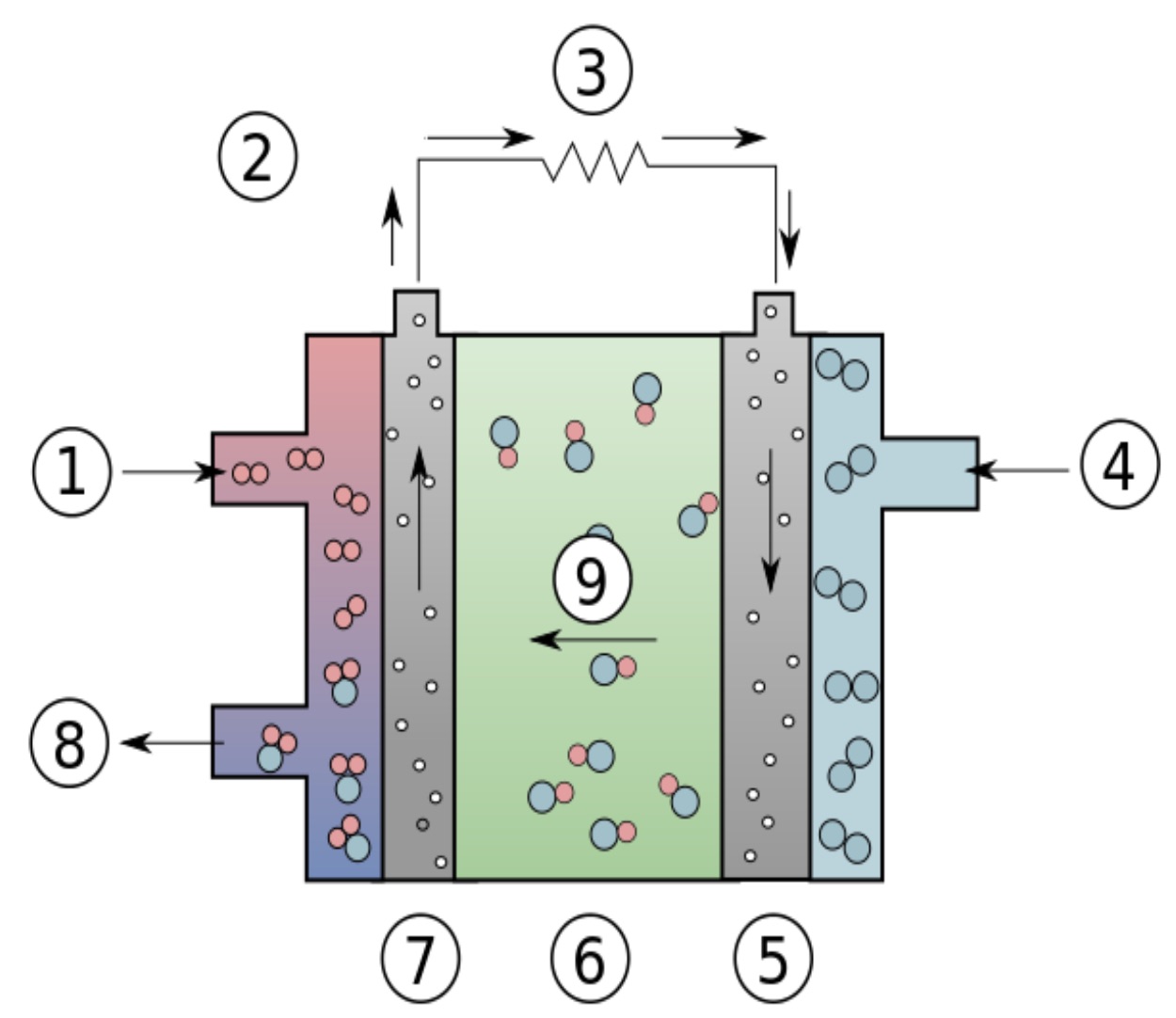
Rys.9. Schemat budowy ogniwa paliwowego: 1 – wodór, 2 – przepływ elektronów, 3 – ładowanie (odbiornik energii), 4 – tlen, 5 – katoda, 6 – elektrolit, 7 – anoda, 8 – woda, 9 – jony hydroksylowe (pl.wikipedia.org/wiki/Alkaliczne_ogniwo_paliwowe).
Rewolucja ekologiczna – samochody na wodór
Z uwagi na liczne zalety, jakie posiadają ogniwa paliwowe, zaczęto je z powodzeniem stosować w dziedzinie transportu. Szczególnie systemy mobilne dużej mocy używa się do zasilania najróżniejszych pojazdów. Samochody napędzane w ten sposób, oprócz braku szkodliwości dla środowiska, wykazują znaczną przewagę nad pojazdami posiadającymi silniki spalinowe, ponieważ cechują się większą sprawnością. Dodatkowo ogniwa paliwowe działają niemalże bezgłośnie, ponieważ nie składają się z żadnych tłoków i innych ruchomych części. To wszystko sprawia, że możemy wyobrazić sobie wizję przyszłości, w której zagoszczą czyste i ciche ulice (Feldzensztajn i in., 2003).
Z tego powodu wykorzystaniem ogniw wodorowych zainteresowały się takie koncerny motoryzacyjne jak Toyota, Honda czy Ford. Już w 2008 roku Japonia zaczęła produkować model samochodu osobowego Honda FCX Clarity, który jest napędzany ogniwami paliwowymi zasilanymi H2. Tankowanie pojazdu wodorem odbywa się na specjalnie przystosowanych stacjach wodorowych. Gaz ten spalany jest za pomocą tlenu w ogniwie paliwowym (silnik chemiczny) i zamienia energię chemiczną na elektryczną zasilającą silnik elektryczny o mocy 136 KM, a efektem spalania jest jedynie para wodna. Energia elektryczna przechowywana jest w 288 V baterii litowo-jonowej. Auto rozpędza się do 160 km/h, a jego zasięg na jednym baku wynosi ok. 430 km. Jest to samochód osobowy klasy średniej napędzany wodorem produkowany w latach 2008 – 2015 w Japonii przez koncern motoryzacyjny Honda, a dostępny jedynie w Stanach Zjednoczonych w Kalifornii oraz w Japonii (14 egzemplarzy) i Europie (2 egzemplarze).
Literatura
1. Adams M.W.W., Stiefel E.I. 1998: Biological hydrogen production: not so elementary. Science. 282, 1842-1843.
2. Argun H., Gokfiliz P., Karapinar I. 2016: Biohydrogen production potential of different biomass sources. (Singh A., Rathore D. eds.) Biohydrogen Production: Sustainability of Current Technology and Future Perspective. Springer India. 11-48.
3. Barlow Z. 2013: Breakthrough in hydrogen fuel production could revolutionize alternative energy market. Virginia Tech News.
4. Brentner L.B., Jordan P.A., Zimmerman J.B. 2010: Challenges in developing biohydrogen as a sustainable energy source: Implications for a research agenda. Environmental Science & Technology. 44, 2243–2254.
5. Burek R. 1998: Encyklopedia popularna PWN, Wydawnictwo Naukowe PWN SA, Warszawa.
6. Chandrasekhar K., Lee Y-J., Lee D-W. 2015: Biohydrogen production: strategies to improve process efficiency through microbial routes. International Journal of Molecular Sciences. 16, 8266-8293.
7. Connihan M.A. 1981: Dictionary of Energy. Routledge & Kegan Paul. Londyn.
8. Cook B. 2001: An Introduction to Fuel Cells and Hydrogen Technology. University of Nottingham Malaysia Campus. Vancouver.
9. Daintith J. (red.) 2008: A Dictionary of Chemistry. Oxford University Press. Oksford.
10. Das D., Veziroglu T.N. 2008: Advances in biological hydrogen production processes. International Journal of Hydrogen Energy. 33, 6046-6057.
11. De Vrije T., De Haas G.G., Tan G.B., Keijsers E.R.P., Claassen P.A.M. 2002: Pretreatment of miscanthus for hydrogen production by Thermotogaelfii. International Journal of Hydrogen Energy. 27, 1381–1390.
12. Demirbas A. 2009: Biohydrogen – For Future Engine Fuel Demands. Springer Verlag. Londyn.
13. Dudek M., Dębowski M., Grala A., Zieliński M., Rokicka M., Kupczyk K. 2014: Produkcja wodoru w procesach biologicznych prowadzonych przez glony. Uniwersytet Warmińsko-Mazurski w Olsztynie. Olsztyn.1-13.
14. Dworkin M., Gutnick D., 2012: Sergei Winogradsky: a founder of modern microbiology and the first microbial ecologist. FEMS Microbiology Reviews. 36, 364-379.
15. en.wikipedia.org/wiki/Enterobacter_cloacae
16. Feldzensztajn A., Pacuła L., Pusz J. 2003: Wodór „paliwem” przyszłości. Intech. Instytut Wdrożeń Technicznych. 1-9.
17. Hallenbeck P.C., Ghosh D., Skonieczny M.T., Yargeau V. 2009: Microbiological and engineering aspects of biohydrogen production. Indian Journal of Microbiology. 49, 48–59.
18. Hamilton T. JGI Genomes Online Database. Clostridium pasteurianum: organism metadata. Retrieved 29 November 2015.
19. Jones L. W. 1970: Toward a liquid hydrogen fuel economy. University of Michigan. Engineering Technical Report UMR2320.
20. Kotay S. M., Das D. 2008: Biohydrogen as a renewable energy resource—Prospects and potentials. International Journal of Hydrogen Energy. 33, 258-263.
21. Kozłowski K., Dach J., Lewicki A., Cieślik M., Czekała W., Janczak D., Smurzyńska A., Carmona P.C.R. 2016: Biologiczne sposoby produkcji wodoru. Uniwersytet Przyrodniczy w Poznaniu, Instytut Inżynierii Biosystemów. 26-28.
22. Krzemińska I., Kwietniewska E. 2011: Procesy biologicznej produkcji wodoru. Autobusy : Technika, Eksploatacja, Systemy Transportowe. 12, 271-275.
23. Levin D.B., Chahine R. 2010: Challenges for renewable hydrogen production from biomass. International Journal of Hydrogen Energy. 35, 4962-4969.
24. Liu D., Angelidaki I., Zeng R. J., Min B. 2008: Bio-hydrogen Production by Dark Fermentation from Organic Wastes and Residues. Department of Environmental Engineering Technical University of Denmark. Kongens Lyngby.
25. McKendry P. 2002: Energy production from biomass (part 1): overview of biomass. Bioresource Technology. 83, 37–46.
26. Melis A., Happe T. 2001: Hydrogen production. Green algae as a source of energy. Journal of Plant Physiology. 127, 740–748.
27. Melis A., Melnicki M. R. 2006: Integrated biological hydrogen production. International Journal of Hydrogen Energy. 31, 1563-1573.
28. microbewiki.kenyon.edu/index.php/File:Rrub2.jpg
29. Moritz M. 2012: Biological methods for obtaining hydrogen. Chemik. 66, 827-834.
30. Najafpour G., Ismail K., Younesi H., Mohamed A.R., Kamaruddin A.H. 2004: Hydrogen as clean fuel via continuous fermentation by anaerobic photosynthetic bacteria Rhodospirillum rubrum. African Journal of Biotechnology. 3, 503-507.
31. Nandi R., Sengupta S. 2015: Microbial production of hydrogen: an overview. Critical Reviews in Microbiology. 24, 61-84.
32. Nath K., Das D. 2003: Hydrogen from biomass. Current Science. 85, 265–271.
33. Orlygsson J. 2010: Biological Hydrogen Production. University of Akureyri. Reykjavik.
34. pl.wikipedia.org/wiki/Alkaliczne_ogniwo_paliwowe
35. Pudge I.B., Daugulis A.J., Dubois C. 2003: The use of Enterobacter cloacae ATCC 43560 in the development of a two-phase partitioning bioreactor for the destruction of hexahydro-1,3,5-trinitro-1,3,5-s-triazine (RDX). Journal of Biotechnology. 10, 65–75.
36. Rand D., Dell R.M. 2008: Hydrogen Energy – Challenges and Prospects. RSC Publishing. Cambrigde.
37. Rögner M. 2015: Biohydrogen. De Gruyter. Berlin/ Monachium/ Boston.
38. Rupprecht J., Hankamer B., Mussgnug J.H., Ananyev G., Dismukes C., Kruse O. 2006: Perspectives and advances of biological H2 production in microorganisms. Applied Microbiology and Biotechnology. 72: 442-449.
39. Saifuddi N.M. 2016: Developments in bio-hydrogen production from algae: a review. Research Journal of Applied Sciences. Engineering and Technology. 12:968-982.
40. Schramm D. N. 1996: The Big Bang and Other Explosions in Nuclear and Particle Astrophysics. World Scientific Publishing Co. Pte. Ltd. Richmond.
41. Sikora A. 2008: Produkcja wodoru w procesach prowadzonych przez drobnoustroje. Postępy Mikrobiologii. 47,465-482.
42. Szewczyk K. 2008: Biologiczne wytwarzanie wodoru. Postępy Mikrobiologii. 47, 241-247.
43. tergopower.com/en/general-information-about-biomass/
44. Urbaniec K., Grabarczyk R. 2005: Kierunki badań nad biologicznymi metodami otrzymywania wodoru jako nośnika energii. Politechnika Warszawska. Płock.
45. Venkata M.S., Pandey A. 2013: Biohydrogen Production: An Introduction in Biohydrogen. (Pandey, A., Chang, J.-S., Hallenbeck, P.C., Larroche, C., eds.) Elsevier. Amsterdam.
46. www.bacteriainphotos.com/Enterobacter%20cloacae%20light%20microscopy.html
47. www.eia.gov/energyexplained/index.cfm?page=hydrogen_production
48. Guan Y., Deng M., Yu X., Zhang W. 2004: Two-stage photo-biological production of hydrogen by marine green alga Platymonas subcordiformis. Biochemical Engineering Journal. 19, 69–73.

