Autor: Jakub Mitręga
Budowa, podział oraz występowanie sirtuin
Sirtuiny są deacetylazami, tj. enzymami przeprowadzającymi reakcję odszczepienia grup acetylowych od różnych klas białek. Posiadają konserwatywną, katalityczną domenę NAD+-zależną. Obecnie dzieli się je na siedem grup u ludzi i myszy, z kolei u drożdży na trzy. U tych pierwszych oznacza się je jako SIRT1-7, a u drugich Hst1-3. Ponadto podzielono je na 4 klasy: klasa pierwsza zawiera sirtuiny od pierwszej do trzeciej, klasa druga – sirtuinę czwartą, klasa trzecia – sirtuinę piątą, oraz klasę czwartą, w której znajdują się sirtuina szósta oraz siódma. Długość wszystkich tych białek waha się w przedziale od 310 do 747 aminokwasów. Najdłuższą jest SIRT1, zaś najkrótszą SIRT5. Sirtuiny występują w różnych kompartmentach (przedziałach komórkowych), przez co wpływają na procesy w nich zachodzące. SIRT1, SIRT6 oraz SIRT7 zlokalizowane są w obrębie jądra komórkowego, przez co wpływają na czynniki transkrypcyjne znajdujące się w nim; SIRT2 – na terenie cytoplazmy, oddziałując z enzymami glikolitcznymi; SIRT3, SIRT4 oraz SIRT5 – na terenie mitochondrium, wpływając na przebieg cyklu Krebsa oraz łańcucha oddechowego. (ryc.1).

Ryc.1. Schemat przedstawiający budowę sirtuin oraz miejsce ich występowania. Kolorem czarnym zaznaczono NAD+ zależne domeny katalityczne. Modyfikacja ryciny na podsawie źródła: Mei i wsp., 2016.
Sirtuiny- ogólna charakterystyka
W wyniku obecności domeny katalitycznej, do prawidłowego funkcjonowania sirtuin niezbędny jest kofaktor w postaci utlenionej formy dinukleotydu nikotynamidoadeninowego. Początkowo uważano, że należą one tylko i wyłącznie do deacetylaz histonowych. Jednakże w miarę postępów w badaniach nad nimi odkryto, iż wpływają one bezpośrednio na inne białka takie jak p53 („strażnik genomu”) czy też różnego rodzaju czynniki transkrypcyjne np. FOXO1 oraz tubuliny. Oprócz deacetylacji niektóre z sirtuin mogą przeprowadzać reakcję ADP-rybozylacji oraz demalonyzacji (odłączenia reszty kwasu malonylowego od substratów).
Funkcje sirtuin
Sirtuiny pełnią szereg funkcji w organizmach żywych. Pierwsza ma miejsce podczas procesów starzenia na poziomie komórkowym. Potwierdzono, iż ograniczenie spożywanych kalorii o 30 do 50% (ang. Calorie restriction, CR) powodowało wydłużenie życia u drożdży poprzez aktywację sirtuin. Mechanizm aktywacji tych białek podczas zjawiska CR jest spowodowany spadkiem ATP, a w konsekwencji aktywacją kinazy AMPK. Kinaza ta fosforyluje różne czynniki transkrypcyjne np. PGC1α, powodując tym samym wzrost ekspresji danych genów. Podczas ograniczania kalorii wzrasta również poziom NAD+, które są kofaktorami sirtuin, przez co aktywność tych białek również wzrasta (ryc.2).
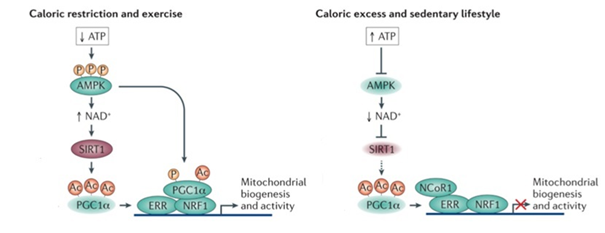
Ryc.2 Schemat przedstawiający aktywację sirtuin poprzez zjawisko Calorie restriction na podstawie ekspresji genów związanych z biogenezą mitochondriów. Ac- grupa acetylowa, P-grupa fosforanowa. Źródło: Houtkooper i wsp., 2012
Sirtuiny wpływają również na metabolizm cukrów oraz tłuszczy. Aktywują one różne czynniki transkrypcyjne np. FOXO1, który powoduje ekspresję genów związanych z glukoneogenezą. Wykazano również, iż białka SIRT oddziałują bezpośrednio z różnymi enzymami szlaków metabolicznych np. z karboksykinazą fosfoenolopirogronianową, zwiększając w ten sposób jej aktywność. Wiele badań wykazało, iż białka te w przypadku metabolizmu cukrów, promują glukoneogenezę przy jednoczesnym spowolnieniu glikolizy (poprzez aktywację odpowiednich czynników transkrypcyjnych), zaś w przypadku metabolizmu tłuszczy inicjują β-oksydację oraz hamują procesy lipogenezy i adipocytogenezy.
Z racji ich aktywności deacetylazowej, mają znaczący wpływ na strukturę chromatyny. Deacetylacja histonów powoduje kondensację chromatyny, a w konsekwencji uniemożliwia ekspresję genów. Jest to ważne ponieważ wiek u drożdży jest definiowany przez liczbę podziałów; jeśli chromatyna jest w stanie skondensowanym nie może dojść do podziału, a w konsekwencji wzrasta długość życia drożdży.
Sirtuiny pełnią ważną rolę podczas stresu oksydacyjnego. Wykazano, iż bezpośrednia ich interakcja z manganową dysmutazą ponadtlenkową (MnSOD) oraz dehydrogenazą NADH zwiększała ich wydajność. Ponad to, poprzez aktywację czynnika transkrypcyjnego FOXO3, zwiększają ilość antyoksydantów.
Wykazano również, że sirtuiny wpływają na procesy naprawcze DNA. Poprzez oddziaływanie z innymi białkami np. XPA, które bierze udział w naprawie przez wycinanie nukleotydu (NER), stymulują ich działanie.
Sirtuiny są potencjalnymi białkami uważanymi za „eliksir młodości”, przez co są ważnym obiektem badań gerontologów. Odkryto związki aktywujące sirtuiny tzw. STACs (ang. Small-Molecule Sirtuin Activating Compounds), dzięki którym istnieje możliwość opóźnienia procesów starzenia. Jednym z aktywatorów jest resweratrol, występujący obficie w skórkach czerwonego winogrona oraz w winie. Oprócz aktywatorów istnieją również inhibitory. Przykładami inhibitorów są: nikotynamid, splitomycyna oraz sirtinol. Na szczególną uwagę zasługuje nikotynamid. Powstaje on w wyniku fizjologicznej aktywności sirtuin, co może stanowić przykład działania sprzężenia zwrotnego ujemnego, hamującego nadmierną aktywność tych białek.
Literatura:
- Feige J.N., Lagouge M., Canto C., Strehle A., Houten S.M., Milne J.C., Lambert P.D., Mataki C., Elliott P.J., Auwerx J. (2008), Specific SIRT1 activation mimics low energy levels and protects against diet-induced metabolic disorders by enhancing fat oxidation. Cell Metab. 8:347–358
- Haigis M.C., Deng C.X., Finley L.W.S., Kim H.S., Gius D. (2012), SIRT3 is a mitochondrial tumor suppressor: a scientific tale that connects aberrant cellular ROS, the Warburg effect, and carcinogenesis. Cancer Res., 72(10):2468–2472
- Houtkooper R.H., Pirinen E., Auwerx J. (2012), Sirtuins as regulators of metabolism and healthspan. Nat Rev Mol Cell Biol., 13:225–38
- Howitz K.T., Bitterman K.J., Cohen H.Y., Lamming D.W., Lavu S., Wood J.G., Zipkin R.E., Chung P., Kisielewski A., Zhang L.L., Scherer B., Sinclair D.A. (2003), Small molecule activators of Sirtuins extend Saccharomyces cerevisiae lifespan. Nature, 425:191–196.
- Iwahara T., Bonasio R., Narendra V., Reinberg D. (2012), SIRT3 functions in the nucleus in the control of stress-related gene expression. Mol Cell Biol., 32:5022– 34
- Jęśko H., Wencel P., Strosznajder R. P., Strosznajder J. B. (2016), Sirtuins and Their Roles in Brain Aging and Neurodegenerative Disorders. Neurochemical Research, 42:876–890
- Mei Z., Zhang X., Yi J., Huang J., He J., Tao Y. (2016), Sirtuins in metabolism, DNA repair and cancer. Journal of Experimental & Clinical Cancer Research , 35(1), 182:1-14.
- Siedlecka K., Bogusławski W. (2015), Sirtuiny — enzymy długowieczności ? , Gerontologia Polska, 13(3):147–152
- Ye X., Li M., Hou T., Gao T., Zhu W.G., Yang Y. (2016), Sirtuins in glucose and lipid metabolism. Oncotarget, Advance Publications, DOI: 10.18632/oncotarget.12157

