Autorzy: Natalia Bryniarska1, Andrzej Kubiak1
natalia.bryniarska@student.uj.edu.pl
1Zakład Biologii Komórki
Wydział Biochemii, Biofizyki i Biotechnologii
Uniwersytet Jagielloński
Wstęp
Komórki macierzyste stanowią obecnie jedną z największych nadziei współczesnej medycyny. Są to komórki mające zdolność do samoodnowy oraz do nieograniczonej proliferacji. Ze względu na potencjał do różnicowania wyróżnia się cztery typy komórek macierzystych:
– totipotencjalne, które mają największą zdolność do różnicowania np. embrionalne komórki macierzyste,
– pluripotencjalne, mogące różnicować się w komórki wszystkich trzech listków zarodkowych,
– multipotencjalne,
–unipotencjalne, które mają najmniejszą zdolność do różnicowania.
Komórki macierzyste wykazują zdolność do podziałów symetrycznych – powstają dwie identyczne komórki i asymetrycznych – jedna zachowuje cechy komórki matczynej podczas gdy druga uzyskuje różny od niej fenotyp. Komórki macierzyste najczęściej pozostają w fazie uśpienia – faza G0, dopiero sygnały pochodzące z niszy mogą uaktywnić je do podziału. Dzięki takim cechom komórki macierzyste spotykają się z tak dużym zainteresowaniem wśród naukowców zajmujących się regeneracją uszkodzonych tkanek.
Komórki macierzyste w regeneracji tkanki nerwowej
Multipotencjalne komórki macierzyste mogą różnicować się w komórki tego listka zarodkowego, z którego powstają w toku rozwoju ontogenetycznego. Przykładem komórek multipotencjalnych są neuralne komórki macierzyste (ang. Neural Stem Cells – NSC). Zlokalizowano je w mózgu dorosłych ssaków, w tym w mózgu człowieka – w strefie podziarnistej obszaru zakrętu zębatego hipokampa (ang. Subgranular Zone – SGZ) oraz w strefie okołokomorowej komór bocznych (ang. Subventricular Zone – SVZ). Ich potencjał do różnicowania pozwala przekształcać się NSC w neurony, komórki gleju, a także oligodendrocyty. NSC można pozyskać z embrionów, jednak stwarza to wiele kontrowersji etycznych. Pozyskanie ich od dorosłych ludzi jest praktycznie niemożliwe. Istnieją co prawda nieliczne linie komórkowe pozyskane od osób przechodzących operacje neurochirurgiczne np. HCN-2 – linia neuronów korowych pobranych podczas operacji hemisferektomii dziewczynki cierpiącej na ostrą epilepsję. Niemniej w tym przypadku nie są to komórki macierzyste. Pobranie NSC jest również niemożliwe na podobnej zasadzie jak pobranie narządów do przeszczepu od ofiar wypadków. Podstawowym kryterium umożliwiającym pobranie organu w takim przypadku jest śmierć mózgowa, która wyklucza pozyskanie zdrowych NSC. Dlatego szukano innych metod uzyskania tych komórek. Jednym sposobem było uzyskanie w 2006 roku przez grupę naukowców na czele z Kazutoshi’ego Takahashi i Shin’yę Yamanaka indukowanych pluripotencjalnych komórek macierzystych (ang. Induced Plurpiotent Stem Cells – IPSC) z somatycznych komórek macierzystych fibroblastów myszy i człowieka. Komórki te wykazują cechy komórek embrionalnych, a uzyskano je przez wprowadzenie czterech genów odpowiedzialnych za pluripotencje: Oct3/4, Sox2, Klf 4 i c-Myc.
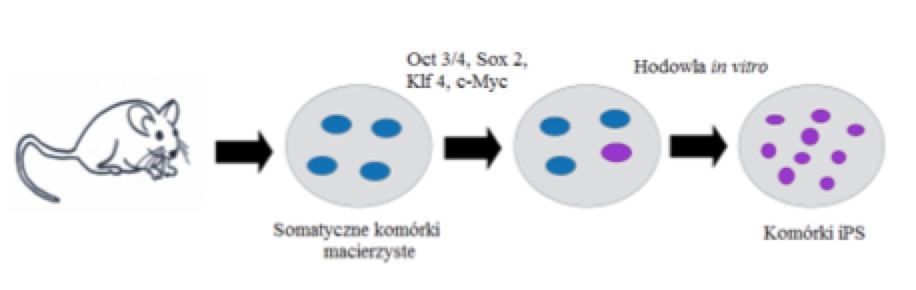
Rys. 1 – metoda otrzymywania indukowanych pluripotencjalnych komórek macierzystych.
Następnie dzięki różnicowaniu IPSC można uzyskać neuralne komórki macierzyste. Taki sposób uzyskania NSC przynosi bardzo wiele korzyści, gdyż komórki nerwowe uzyskane w ten sposób mogą służyć jako model badawczy in vitro chorób neurodegeneracyjnych takich jak choroba Parkinsona, co pozwoli również na testowanie leków czy dobranie terapii indywidualnej dla każdego pacjenta. Co więcej taka metoda zmniejsza możliwość odrzucenia przeszczepu komórek, gdyż pochodziłyby one od tego samego pacjenta. Jednak zastosowanie kliniczne komórek IPSC niesie za sobą zagrożenia wynikające z powstawania potworniaków – łagodnych guzów nowotworowych w budowę których wchodzą komórki wszystkich trzech lisków zarodkowych.
Dentalne komórki macierzyste
Interesującą populacją multipotencjalnych komórek macierzystych zdolnych do różnicowania w komórki neuralne są dentalne komórki macierzyste. Można wyróżnić pięć typów tych komórek:
• komórki macierzyste z ludzkich zębów mlecznych, (ang. Stem cells from Human Exfoliated Deciduous teeth – SHED)
• komórki macierzyste woreczka zębowego (ang. Dental Follicle Stem Cells – DFSC),
• komórki macierzyste wierzchołkowej części brodawki zębowej, (ang. Stem Cells of the Apical part of the Papilla – SCAP),
• komórki macierzyste więzadła ozębnowego, (ang. Periodontal Ligament Stem Cells – PDLSC),
• komórki macierzyste miazgi zęba, (ang. Dental Pulp Stem Cells – DPSC).
Komórki macierzyste miazgi zęba po raz pierwszy dokładnie opisano i zlokalizowano w miazdze zębów stałych w 2000 roku. Wykazywały one charakterystyczne cechy komórek macierzystych, a w szczególności ekspresję markerów mezenchymalnych komórek macierzystych (ang. Mesenchymal Stem Cells – MSC) – komórek obecnych w większości tkanek, szczególnie w niszach okołonaczyniowych. Tymi markerami są: CD29, CD44, CD90, CD117, CD146. Podobnie do MSC większość DPSC nie wykazuj ekspresji markerów hematopoetycznych takich jak: CD34 czy CD45. Niemniej jednak, ponieważ DPSC są bardzo heterogenną populacją części u części z nich można zaobserwować ich obecność. Najistotniejszą cechą DPSC jest obecność markerów neuralnych takich jak nestyna, wimentina, β-tubulina czy neurofilamenty oraz sekrecje czynników neurotroficznych takich jak: neurotropowy czynnik pochodzenia nerwowego (ang. brain-derived neurotrophic factor; BDNF), czynnik wzrostu nerwów (ang. nerve growth factor; NGF) oraz glejopochodny czynnik neurotroficzny (ang. glial cell-derived neurotrophic factor; GDNF).
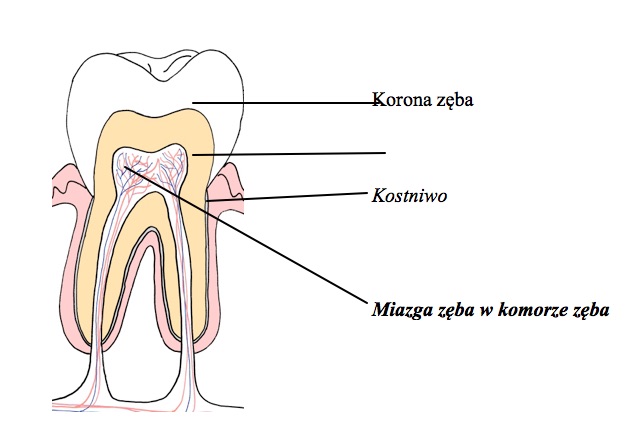
Rys. 2 Budowa anatomiczna zęba z uwzględnieniem głównej niszy DPSC
Neuralnych właściwości DPSC należy upatrywać w ich pochodzeniu. Komórki macierzyste miazgi zęba tak jak pozostałe grupy dentalnych komórek macierzystych wywodzą się z ektodermy – powstając na skutek migracji komórek grzebienia nerwowego. Komórki te powstają w górnej części cewy nerwowej, skąd następnie migrują dając początek innym tkankom np. mięśniom gładkim, melanocytom, tkance nadnerczy, neuronom obwodowym i wielu innym. Niektóre z tych komórek migrują do formującej się jamy ustnej i tutaj biorą udział w rozwoju zębów – tworząc niszę w wewnętrznej części zęba, która staje się miazgą.
Różnicowanie komórek macierzystych miazgi zęba w kierunku neuronów
W związku z ciekawą charakterystyką DPSC opracowano szereg protokołów mających pozwolić na uzyskanie z nich funkcjonalnych neuronów. Jednym z najnowszych protokołów jest opracowany w 2015 roku przez Grontosa i współpracowników Protokół opierający się na dwóch etapach wraz z utworzeniem neurosfer. Neurofery są to kuliste skupiska komórek o charakterze neurlanym o średnicy ok. 150 μm. Ich trójwymiarowa architektura pobudza komórki do różnicowania w kierunku neuronów. Technika ta jest również stosowana przy różnicowaniu IPSC do neuronów. Po przeprowadzeniu różnicowania opierającego się na hodowli komórek z neurosfer w pożywce wzbogaconej min. w cAMP oraz neurotrofinę-3 wykonano szereg testów w celu oceniania stopnia zróżnicowania DPSC w neurony. Badania metodą patch-clamp pokazały, że powstałe po zróżnicowaniu komórki wykazują niektóre cechy elektrofizjologiczne komórek nerwowych. Zmierzono dla nich prąd potasowy jak i sodowy. Po dodaniu tetraetyloaminy (TEA), która blokuje napięciowo zależne kanały potasowe neuronów zaobserwowano zanik prądu, za to jej wypłukanie pozwoliło na odtworzenie prądu potasowego. Podobna sytuacja miała miejsce w przypadku badania napięciowo zależnych kanałów sodowych. Z drugiej strony zarejestrowany w neuronopodobnych komórkach pochodzących z DPSC potencjał czynnościowy nie posiadał wszystkich cech neuronalnego potencjału czynnościowego (np. brak repolaryzacji) stąd też nie można mówić o otrzymaniu w pełni funkcjonalnych neuronów.
Zastosowanie komórek macierzystych miazgi zęba w zwierzęcych modelach schorzeń
Innym przykładem zastosowania dentalnych komórek macierzystych w regeneracji było wykorzystanie komórek macierzystych pochodzących z zębów mlecznych (SHED) na modelu zwierzęcym, gdzie wszczepiono te komórki do mózgu gryzoni po wywołanym u nich uszkodzeniu mózgu (ang. Acute Brain Injury). W efekcie zaobserwowano znaczącą odbudowę kory mózgowej zwierząt w porównaniu z grupami kontrolnymi. W badaniu tym nie wskazano jednak jednoznacznie co stało u podstaw tak skutecznej odbudowy mózgu. Podobne badania przeprowadzono na mysim modelu zawału mięśnia sercowego (ang. Myocardial Infraction). Po wywołaniu uszkodzenia serca gryzoniom podano wyznakowane fluorescencyjne DPSC. W rezultacie po czterech tygodniach zaobserwowano poprawę szeregu parametrów serca takich jak: zmniejszenie obszaru blizny pozawałowej z 20% do 15%, zwiększenie grubości lewej komory o połowę (z 0,6mm do 1,2mm) czy też zwiększenie gęstości naczyń krwionośnych z ok. 500 do ok. 850 na mm2. Dzięki wyznakowaniu fluorescencyjnemu DPSC możliwa była ocena, czy komórki macierzyste miazgi zęba zróżnicowały się w komórki serca. Wynik analizy zdjęć z mikroskopu fluorescencyjnego jednoznacznie wykazał, że DPSC nie zróżnicowały się komórki serca (gdyby tak było sygnał zielonej fluorescencji pochodzący z DPSC nakładałby się z sygnałem czerwonym pochodzącym od wyznakowanych specyficznie markerów komórek serca). Stąd też czynnikami pozwalającymi na regenerację uszkodzonego serca musiały być czynniki parakrynne wydzielane przez DPSC.
Zakończenie
Zarówno podobny do MSC potencjał do różnicowania się w inne tkanki jak i szeroki wachlarz czynników parakrynnych wydzielanych przez DPSC czyni z nich interesującą populację komórek macierzystych. Ich dodatkowymi zaletami jest brak kontrowersji etycznych w pozyskiwaniu i stosunkowo prosta hodowla, które w połączeniu z szeregiem cech neuralnych, które wykazują DPSC sprawia, że stanowią one bardzo dobre źródło komórek do badań neurobiologicznych.
Literatura:
1. Gandia, C., Armiñan, A., García-Verdugo, J. M., Lledó, E., Ruiz, A., Miñana, M. D., Sepúlveda, P. (2008). Human dental pulp stem cells improve left ventricular function, induce angiogenesis, and reduce infarct size in rats with acute myocardial infarction. Stem Cells, 26(3), 638–45. http://doi.org/10.1634/stemcells.2007-0484
2. Gervois, P., Struys, T., Hilkens, P., Bronckaers, A., Ratajczak, J., Politis, C., … Martens, W. (2015). Neurogenic Maturation of Human Dental Pulp Stem Cells Following Neurosphere Generation Induces Morphological and Electrophysiological Characteristics of Functional Neurons. Stem Cells and Development, 24(3), 296–311. http://doi.org/10.1089/scd.2014.0117
3. Gronthos, S., Mankani, M., Brahim, J., Robey, P. G., & Shi, S. (2000). Postnatal human dental pulp stem cells (DPSCs) in vitro and in vivo. Proceedings of the National Academy of Sciences of the United States of America, 97(25), 13625–13630. http://doi.org/10.1073/pnas.240309797
4. Martens, W., Bronckaers, a., Politis, C., Jacobs, R., & Lambrichts, I. (2013). Dental stem cells and their promising role in neural regeneration: An update. Clinical Oral Investigations, 17(9), 1969–1983. http://doi.org/10.1007/s00784-013-1030-3
5. Takahashi, K., Tanabe, K., Ohnuki, M., Narita, M., Ichisaka, T., Tomoda, K., & Yamanaka, S. (2007). Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell, 131(5), 861–72. http://doi.org/10.1016/j.cell.2007.11.019
6. Takahashi, K., & Yamanaka, S. (2006). Induction of Pluripotent Stem Cells from Mouse Embryonic and Adult Fibroblast Cultures by Defined Factors. Cell, 126(4), 663–676. http://doi.org/10.1016/j.cell.2006.07.024
7. Young, F., Sloan, A., & Song, B. (2013). Dental pulp stem cells and their potential roles in central nervous system regeneration and repair. Journal of Neuroscience Research, 91(11), 1383–1393. http://doi.org/10.1002/jnr.23250

