W trakcie embriogenezy, pojedyncza komórka ulega ściśle uporządkowanym podziałom i procesom różnicowania. W wyniku tych przemian dochodzi do uformowania się zarodka, zawiązka nowej rośliny.
W warunkach in vivo taką komórką jest diploidalna zygota, powstała w wyniku zapłodnienia, czyli połączenia się dwóch gamet. W warunkach laboratoryjnych (in vitro) rolę tą mogą spełniać również komórki wegetatywne, których embriogeniczność wyzwalana jest za pomocą odpowiedniego prowadzenia kultury. Otrzymywane w ten sposób zarodki określa się mianem somatycznych, a proces ich formowania się – <br.embriogenezą somatyczną
(ang. somatic embryogenesis, SE).
Zarodki niezygotyczne mogą powstawać również w wyniku
apomiksji
, czyli procesu rozmnażania się roślin z pominięciem fazy zapłodnienia. Przedwczesne uaktywnienie embriogenezy prowadzi do rozwoju zarodka z niezredukowanej komórki macierzystej lub z diploidalnej komórki ośrodka.
Somatyczna embriogeneza pośrednia i bezpośrednia
Wyróżnia się dwa podstawowe typy somatycznej embriogenezy:
bezpośrednią (ang. direct somatic embryogenesis, DSE), w której zarodki powstają z komórek eksplantatu. Bezpośredni sposób formowania się somatycznych zarodków może zachodzić jedynie z udziałem tzw. z pro-embriogenicznie zdeterminowanych komórek (ang. pre-embryogenic determinated cells, PEDC), posiadających naturalne zdolności do totipotencji. Ich wysoką aktywność podziałowa i metaboliczna jest hamowana przez przestrzenne i fizjologiczne relacje panujące w tkance i zostaje wyzwolona w wyniku izolacji komórek z rośliny macierzystej. Głównym bodźcem stymulującym proces embriogenezy bezpośredniej jest, znajdująca się w pożywce, egzogenna auksyna.
pośrednią (ang. indirectsomatic embryogenesis, ISE), zachodzącą poprzez stadium kalusa embriogenicznego, tworzącego się na ekasplantatach roślinnych. Pod wpływem czynników zewnętrznych (tzn. warunków prowadzenia kultury) żywe komórki eksplantatu ulegają odróżnicowaniu (dedyferencjacji) do stanu merystematycznego. W ten sposób powstaje kalus embriogenny, zawierający tzw. indukowane embriogenicznie zdeterminowane komórki (ang. inducet embryogenic determined cells, IEDC), które w kolejnych podziałach doprowadzają do uformowania się pojedynczych komórek masy prioembriogenicznej (PEM) i dają początek somatycznym zarodkom.
Czynniki wpływające na somatyczną embriogenezę
Efektywność procesu somatycznej embriogenezy uwarunkowana jest wieloma czynnikami endogennymi i egzogennymi, m.in. genotypem rośliny, jej stanem fizjologicznym, natężeniem i jakością światła, a także rodzajem oraz stężeniem makro- i mikroelementów zawartych w podłożu.
Zasadniczą rolę odgrywają również fitohormony, czyli roślinne regulatory wzrostu, które decydują o uzyskaniu przez komórkę totipotencjalności oraz umożliwiają prawidłowy przebieg i wysoką wydajność całego procesu. Ich rodzaj oraz stężenie zależą od gatunku rośliny i ulegają zmianom na poszczególnych etapach formowania się zarodka.
Przykładowo, stymulatory wzrostu, takie jak auksyny i cytokininy, są niezbędne podczas namnażania się komórek, jednak hamują procesy ich różnicowania się. W fazie dojrzewania należy je zastąpić kwasem abscysynowym, zwanym również hormonem stresu. Jego dodatek stymuluje m.in. syntezę i gromadzenie się substancji zapasowych oraz indukuje tolerancję na desykację i spoczynek, co pozwala zapobiec przedwczesnemu kiełkowaniu.
Niepotrzebne fitohormony, związki fenolowe i substancje toksyczne można usunąć dodając do podłoża węgiel aktywny.
Podczas procesu różnicowania się, istotną rolę odgrywają także miejscowe interakcje sąsiadujących ze sobą komórek oraz tzw. substancje krótkodystansowe, m.in. obecne w marchwi endochitynaza EP3 oraz arabinogalaktan (AGP).
Etapy somatycznej embriogenezy
Przebieg somatycznej embriogenezy można podzielić na następujące fazy:
1. faza „0”, faza determinacji (ang. determination phase), faza indukcji (ang. induction phase), w której odróżnicowane komórki somatyczne nabierają kompetencji do embriogenezy. Faza ta nie ma bezpośredniego odpowiednika w embriogenezie zygotycznej;
2. faza namnażania, polegająca na proliferacji agregatów prioembriogenicznej masy komórek (PEM);
3. faza różnicowania, której przebieg jest podobny do embriogenezy zygotycznej. Na tym etapie komórki ujawniają swoje właściwości embriogeniczne i formują somatyczne zarodki. Różnicowanie się komórek prowadzi do ich specjalizacji i obejmuje wiele powiązanych ze sobą procesów natury chemicznej, fizjologicznej i morfologicznej. W ich wyniku dochodzi do zmian właściwości poszczególnych komórek oraz tworzenia się ich wzajemnych interakcji;
4. faza dojrzewania zakończona uzyskaniem funkcjonalnych zarodków, które można wykorzystywać jako tzw. sztuczne nasiona (ang. somseed, artificial seed, synthetic seed).
Do kiełkowania somatycznych zarodków stosuje się pożywkę pozbawioną hormonów. W niektórych przypadkach poddaje się je wcześniej różnym zabiegom utrwalającym, takim jak np. wysuszanie.
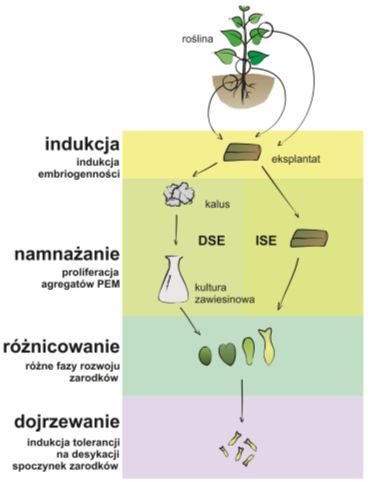
Rys.1 Etapy embriogenezy somatycznej
Kiełkowanie i konwersja zarodków
Powstała w warunkach in vitro siewka musi być zdolna do przeżycia, wzrostu i rozwoju w warunkach naturalnych, tzn. niesterylnych (ex vitro).
W zarodkach somatycznych merystemy wierzchołkowe pędów są bardziej wrażliwe na stres desykacyjny niż merystemy korzenia. Z tego względu ich kiełkowanie określa się niekiedy jako zdolność do formowania korzonka zarodkowego, a konwersję, czyli rozwój rośliny somatycznej, jako równoczesny rozwój korzonka i pędu.
Kiełkowaniu i konwersji mogą ulegać jedynie zarodki dojrzałe, które uzyskały już tolerancję na desykację i charakteryzują się prawidłową budową oraz wystarczającą ilością zakumulowanych materiałów zapasowych. Ich rozwój jest zazwyczaj wolniejszy niż rozwój nasion.
Główną tego przyczyną jest brak odpowiedniej ilości materiałów zapasowych, ich szybsza hydroliza oraz odmienne drogi syntezy. Ponadto, zarodki somatyczne są często narażone na utratę żywotności w wyniku nieodpowiedniego suszenia oraz niedostatecznej tolerancji na ten proces. W niektórych przypadkach można również obserwować anormalny rozwój stożka wzrostu pędu oraz słaby rozwój liścieni, co przyczynia się do gromadzenia materiałów zapasowych w hipokotylu.
Wigor somatycznych zarodków można poprawić dzięki zastosowaniu odpowiednich hormonów: giberelin, etylenu i kwasu abscysynowego.
Geny zaangażowane w proces embriogenezy
Zmiany morfologiczne i biochemiczne, zachodzące podczas somatycznej embriogenezy w zaindukowanej tkance są ściśle związane z aktywnością odpowiednich genów. Niektóre z nich ulegają ekspresji na początkowych etapach, tzn. podczas indukcji embriogeniczności, inne w trakcie różnicowania się i dojrzewania zarodków.
Rolę poszczególnych genów można badać dzięki zastosowaniu mutantów zarodkowych, znajdujących się we wczesnych stadiach embriogenezy lub takich, u których rozwój zarodka zatrzymano na ściśle określonym stadium.
W ten sposób odkryto, że markerem molekularnym kompetencji komórek do przekształcenia się z masy proembriogenicznej w zarodki somatyczne jest kinaza receptorowa kodowana przez geny SERK (ang. somatic embryogenesis receptor kinase).
Białka SERK po raz pierwszy wyizolowano z zawiesin komórkowych marchwi. Należą one do nadrodziny roślinnych kinaz białkowych (RLK) i są zbudowane z peptydu sygnalnego i domeny zewnątrzkomórkowej składającej się z zamka leucytowego, pięciu powtórzeń bogatych w leucynę (LRRs), pojedynczej domeny transmembranowej, domeny kinazy wewnątrzkomórkowej, 11 konserwowanych subdomen należących do kinaz serynowo-treoninowych oraz domeny bogatej w prolinę (SPP), która odróżnia je od innych białek RLK.
Ich ekspresja różni się podczas somatycznej i zygotycznej embriogenezy i zależy od warunków prowadzenia kultury.
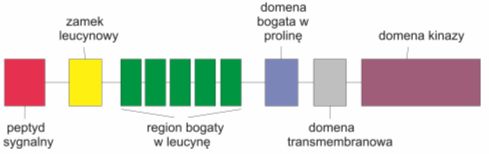
Rys. 2. Schemat rozmieszczenia domen w rodzinie białek SERK
Do pozostałych genów zaangażowanych w formowanie się somatycznych zarodków należą m.in.:
Geny LEC (ang. Leafy Cotyledon) odkryte u rzodkiewnika (LEC1, LEC2 I FUS3). Kodują one białka stanowiące grupę regulatorów zaangażowanych w prawidłowy rozwój zarodka podczas morfogenezy i dojrzewania. Wykazują działanie plejotropowe i wpływają na morfologię liścieni u siewki, rozwój wieszadełka i fazę dojrzewania zarodka. Odpowiadają również za nabycie potencjału embriogenicznego i jako czynniki transkrypcyjne odgrywają główną rolę w indukcji zarodkowego szlaku rozwojowego podczas somatycznej embriogenezy w kulturach in vitro.
Zmiany w potencjale embriogennym, niezależne od hormonów, zaobserwowano również u mutanta rzodkiewnika piekle (pkl). Gen PKL koduje białko CHD3, które wpływa na strukturalną organizację chromatyny, a tym samym reguluje transkrypcję genu LEC1.
Gen BBM (ang. baby boom) zidentyfikowany u rzodkiewnika i rzepaku posiada dwie domeny AP2/ERF wiążące DNA. Należy on do czynników transkrypcyjnych odgrywających rolę w regulacji szlaków związanych z embriogenezą, a jego ekspresja zachodzi we wczesnych i późnych fazach rozwoju zarodka.
AGL15 (ang. agamous-like) przedstawiciel rodziny regulatorów transkrypcji zawierających domenę MADS. Akumulowany we wczesnych etapach rozwoju zarodka roślin jedno- i dwuliściennych.
Gen PEI1 koduje białko zawierające domenę z motywem palców cynkowych o budowie charakterystycznej dla zwierzęcych i grzybowych czynników transkrypcyjnych. Jest on zarodko-specyficznym czynnikiem transkrypcyjnym zaangażowanym w rozwój wierzchołkowej części zarodka.
Gen NiR (ang. ferredoxin-nitrate reductase) koduje reduktazę azotynową, redukującą toksyczne dla komórek roślinnych jony azotynowe do amonowych. Jest to gen o podstawowej roli dla zapoczątkowania procesu morfogenezy in vitro, w tym embriogenezy somatycznej. Nie odgrywa jednak większej roli w różnicowaniu się zygoty.
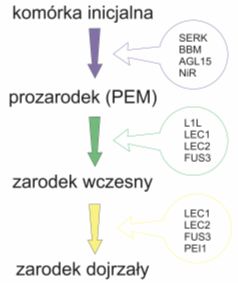
Rys. 3. Ekspresja genów w trakcie embriogenezy somatycznej
Embriogeneza zygotyczna, a somatyczna
W przebiegu somatycznej i zygotycznej embriogenezy istnieją zasadnicze różnice:
1) zarodki zygotyczne in vivo rozwijają się w woreczku zalążkowym w wyniku fuzji gamet, natomiast somatyczne w naczyniach hodowlanych tzn. w warunkach in vitro;
2) rozwijający się prozarodek ulega procesom różnicowania prowadzącym do wykształcenia się osi pędowo-korzeniowej (apikalno-bazalnej) i w ten sposób ulega przekształceniu z kulistego w spolaryzowany. W przypadku embriogenezy zygotycznej wpływ na ten proces ma polarność komórki jajowej, natomiast w embriogenezie somatycznej nie obserwuje się bezpośredniego wpływu tkanki macierzystej, a polarność zarodka jest indukowana warunkami prowadzenia kultury;
3) globularne stadia zarodków somatycznych są większe niż zygotycznych;
4) zarodki zygotyczne znajdujące się w stadium wczesnoglobularnym rozwijają tzw. wieszadełko, czyli suspensor. Dostarcza ono zarodkowi substancje pokarmowych, a także jest miejscem syntezy stymulatorów wzrostu i fitohormonów. Zarodki somatyczne nie wykształcają suspensora;
5) merystem wierzchołkowy zarodków somatycznych jest słabiej rozwinięty niż w przypadku zarodków zygotycznych;
6) zarodki zygotyczne roślin okrytozalążkowych wytwarzają jeden (jednoliścienne) lub dwa (dwuliścienne) liścienie. Zarodki somatyczne wytwarzają ich dwa lub więcej i często niewielkie;
7) produkcja materiałów zapasowych w zarodkach somatycznych odbywa się w innym czasie, miejscu oraz w innych ilościach niż ma to miejsce w zarodkach zygotycznych. Między innymi w procesie somatycznej embriogenezy nie wytwarza się bielmo;
8) zarodki zygotyczne otacza okrywa nasienna, która nie tworzy się podczas rozwoju zarodków somatycznych. Wpływa to na brak takich stadiów rozwojowych jak stadium liścieniowe w postaci „laski” i odwróconej litery U;
9) rozwój zygotycznego zarodka kończy się powolnym odwodnieniem, stopniowym obniżeniem metabolizmu i wejściem w stan spoczynku. Somatyczne zarodki charakteryzują się dużą zawartością wody i w związku z tym nie znoszą intensywnego suszenia. Nie przechodzą one okresu uśpienia, kiełkują przedwcześnie, a otrzymane z nich rośliny charakteryzują się niską zdolnością do przeżywania w warunkach ex vitro.
Zastosowanie embriogenezy somatycznej
Somatyczna embriogeneza prowadzi do wytworzenia dużej liczby genetycznie identycznych osobników (klonów) z małej ilości materiału wyjściowego (eksplantatu). Pozwala ona zatem, skuteczniej niż rozmnażanie generatywne, zachować pożądane cechy hodowlane u potomstwa i z tego względu stanowi szybką i wydajną alternatywę dla tradycyjnych metod produkcji roślinnej.
Dzięki somatycznej embriogenezie można uniezależnić rozmnażanie od panujących warunków klimatycznych, a także ulepszać nasiona u roślin charakteryzujących się długim cyklem produkcji i okresowością kwitnienia.
Technika ta daje również możliwość otrzymania w krótkim czasie wyselekcjonowanego materiału sadzeniowego, ulepszonego genetycznie pod kątem wartościowych cech.
Ułatwia to regeneracje niektórych gatunków, namnażanie nowych form roślin uzyskanych przez krzyżowanie, a także rozmnażanie gatunków, których nasiona są trudne do przechowywania przez długi okres lub które produkują nasiona późno i nieregularnie.
Autor: Anna Kurcek
Literatura:
1. Grabowska A., Filipecki M., Linkiewicz A., 2001. Genetyczna regulacja embriogenezy u roślin. Postępy Biologii Komórki, 4 (28): 509-527.
2. Gruszczyńska A., Rakoczy-Trojanowska M., 2007. Charakterystyka genów ulegających ekspresji podczas somatycznej embriogenezy u roślin. Biotechnologia, 1(76): 96-106.Szczygieł K., 2005. Somatyczna embriogeneza – alternatywny sposób uzyskania wyselekcjonowanego materiału sadzeniowego gatunków drzew iglastych. Leśne Prace Badawcze, 3: 71-92.
3. Kępczyńska E., 2006. Kiełkowanie i konwersja somatyczna zarodków in vitro. Biotechnologia, 4 (75): 78-94.
4. Pawan K. J., Rana P. S., 2003. Improvement strategies of leguminosae biotechnology. Kluwer Academic Publishers. USA.
5. Santos M. O., Aragão F. J. L., 2009. Role of SERK genes in plant environmental response. Plant Signal Behav, 4(12): 1111–1113.
6. Shyama Ranjani Weerakoon S. R., 2010. Direct and Indirect Somatic Embryogenesis from Petiole and Leaf Explants of Purple Fan Flower (Scaevola aemula R. Br. cv. ‘Purple Fanfare’).World Academy of Science, Engineering and Technology, 65:872-880.
7. Zavattieri M. A., Frederico A. M., Lima M., 2010. Induction of somatic embryogenesis as an example of stress-related plant reactions. Electronic Journal of Biotechnology, 1 (13): 1-9.

