Mikotoksyny (gr. „mycos” – grzyb, łac. „toxicum” – trucizna) są to wtórne produkty przemiany materii grzybów pleśniowych. Zdolność do ich wytwarzania jest naturalną i dość często występującą cechą. Ich szkodliwe działanie względem organizmów żywych ujawnia się już w niewielkich stężeniach, czyli na poziomie około jednego miligrama w kilogramie ziarna zbóż, przetworów zbożowych, pasz i innych produktów. Spożycie zakażonej żywności oraz kontakt z zarodnikami może stać się przyczyną groźnych zatruć zwanych mikotoksykozami.
Rodzaje mikotoksyn
Z punktu widzenia praktyki rolniczej mikotoksyny dzieli się na takie, które powstają w wyniku chorób roślin występujących jeszcze przed żniwami oraz na metabolity związane z przechowalniczymi chorobami pożniwnymi, czyli tzw. pleśnieniem płodów, spowodowanym nieodpowiednimi warunkami przechowywania produktów roślinnych.
Wyróżnia się także tzw. endotoksyny – magazynowane wewnątrz grzybni oraz egzotoksyny dyfundujące do środowiska zewnętrznego, tj. powietrza, gleby.
Pojęcie mikotoksyny na ogół zawęża się do zootoksyn, niebezpiecznych dla zwierząt i człowieka. Często zapomina się o ich fitotoksycznym (hamującym wzrost i metabolizm roślin) i antybiotycznym (szkodliwym dla innych drobnoustrojów – grzybów, bakterii) działaniu. Ze względu na silne właściwości toksyczne związki te nie mogą być jednak stosowane w medycynie, weterynarii, ani w przemyśle spożywczym.
Mikotoksykozy
Nazwą mikotoksykoza określa się zatrucie – ostre, chroniczne lub przewlekłe, wywołane spożyciem toksyn grzybowych. Tego typu dolegliwości znane były ludziom już od wieków i jako „kara boska” towarzyszyły głodowi oraz wojnom za czasów średniowiecza. Dziś wiemy, że ich główną przyczyną była mała dostępność żywności oraz złe warunki jej przechowywania. Pierwsze naukowe dane z tego zakresu pochodzą jednak dopiero z roku 1711. Przełomowy okazał się rok 1960, w którym to, w wyniku wystąpienia masowego zatrucie indyków w Anglii, rozpoczęto pierwsze badania nad aflatoksynami. Podczas wojny w Wietnamie (lata 1975-1981) mikotoksyny fuzaryjne – trichoteceny wykorzystano jako broń biologiczną.
Mikotoksykoz nie należy mylić z mikozami, czyli chorobami wywołanymi rozwojem grzybów w organizmie ludzkim lub zwierzęcym, np. często występującą grzybicą skóry lub rzadszą, lecz bardzo groźną grzybicą płuc.
Zootoksyczne działanie mikotoksyn
Mikotoksykozy są często przyczyną dużych strat ekonomicznych dla hodowców zwierząt. Przy zatruciu ostrym następuje śmierć całego stada lub jego znacznego procentu. Zatrucia podostre i przewlekłe objawiają się zmniejszeniem przyrostu masy ciała, gorszym wykorzystaniem paszy oraz obniżeniem odporności na choroby.
Ogólnym objawom zatrucia mikotoksynami towarzyszą często symptomy specyficzne dla danej grupy związków, takie jak np. uszkodzenia nerek w przypadku ochratoksyny A, zmiany i nowotwory wątroby w przypadku aflatoksyn, zaburzenia płodności trzody wywołane przez zearalenon.
W zależności od uszkadzanego organu, mikotoksyny można podzielić na:
• hepatotosyny – atakujące wątrobę (aflatoksyna B1 i inne);
• pulmotoksyny – wywołujące obrzęki płuc (fumonizyna B1);
• nefrotoksyny – których działanie obejmuje głównie nerki (ochratoksyna A);
• kardiotoksyny – dotyczące serca i układu krwionośnego (moniliformina);
• dermatotoksyny – prowadzące do uszkodzeń skóry i błon śluzowych (T-2 toksyna i inne trichoteceny);
• neurotoksyny – powodujące uszkodzenia centralnego układu nerwowego (alkaloidy sporyszu, fumonizyna B1).
Ponadto, jako oddzielne grupy wyróżnia się:
• związki kancerogenne – przyczyniające się do powstawania nowotworów (aflatoksyny, fumonizyny, ochratoksyny);
• mikohormony – działające na regulację hormonalną (zearalenon i jego pochodne);
• immunotoksyny – wpływające negatywnie na odporność organizmu (trichoteceny i szereg innych miko toksyn.
Podział ten nie jest sztywny i przykładowo metabolity grzybów z rodzaju Fusarium lokują się we wszystkich powyższych grupach.
Drogi zakażeń mikotoksynami
Grzyby pleśniowe są szeroko rozpowszechnione w otaczającym nas środowisku. Jednym z największych zagrożeń dla człowieka są gatunki wzrastające w zawilgoconych budynkach mieszkalnych. W powietrzu rozsiane są ich zarodniki, które niosą duże ilości mikotoksyn. Kontakt z nimi następuje poprzez inhalację oraz skórę. Ich rozprzestrzenianiu się w przewodach wentylacyjnych dodatkowo sprzyjają klimatyzacja oraz systemy nawilżające. Wysoką aktywność grzybów pleśniowych wytwarzających mikotoksyny wykryto w budynkach mieszkalnych na terenach popowodziowych. Grzyby należące do rodzaju Alternaria często rozwijają się w domach ocieplanych watą szklaną. Pod tapetami i wykładzinami wzrastają grzyby należące do rodzaju Penicillium i <em.Aspergillus, a Stachybotrys chartarum rośnie na materiałach z wysoką zawartością celulozy i niskim poziomem azotu, takich jak: papier, drewno, płótno, kurz, płyta pilśniowa, ściany gipsowe.
Bardzo często zatrucie mikotoksynami następuje w wyniku spożycia zakażonej żywności, głównie zboża, warzyw, orzechów i innych nasion oleistych, nasion roślin strączkowych, owoców i przypraw. Ważnym źródłem mikotoksyn jest pasza, a mięso, mleko i jaja pochodzące z zakażonych zwierząt mogą stanowić poważne zagrożenie dla zdrowia człowieka.
Produkty zakażone grzybami pleśniowymi nie zawsze zawierają mikotoksyny. Według niektórych badań, wtórne metabolity grzybowe mogą być wytwarzane bezpośrednio w ustroju człowieka, to znaczy już po spożyciu przez nas zainfekowanego pokarmu. Samo usunięcie grzybni nie eliminuje mikotoksyn, które pozostają niewrażliwe na wiele procesów technologicznych, takich jak gotowanie, smażenie, pieczenie, destylacja, fermentacja. Toksyczne mogą być zatem zarówno przetwory wykonane z zanieczyszczonych surowców, jak i produkty, na których nie obserwuje się strzępek grzybów pleśniowych.
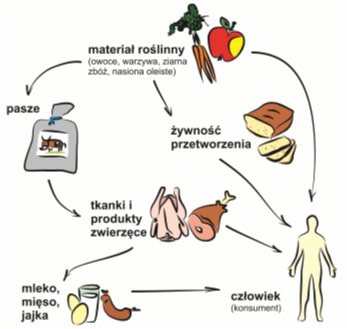
Rys. 1. Schemat ilustrujący sposoby przedostawania się mikotoksyn do żywności
Tab. 1. Przegląd mikotoksyn występujących w produktach spożywczych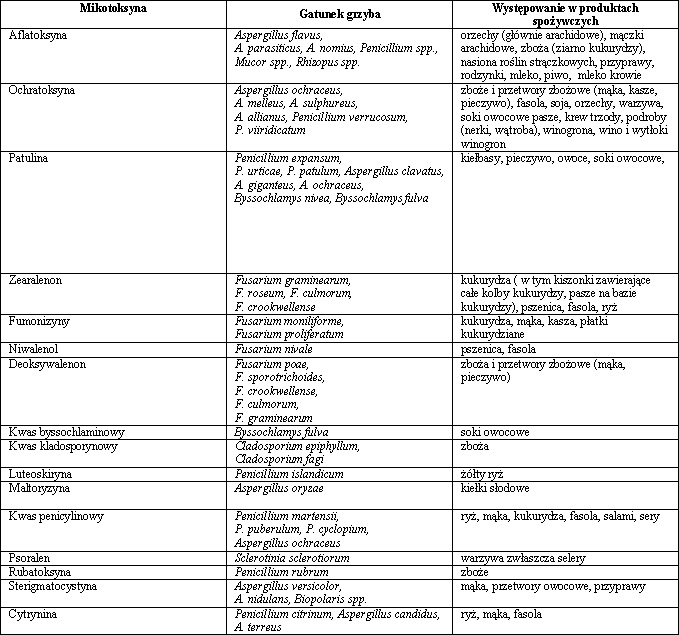
Czynniki wpływające na produkcję mikotoksyn
Na wydajność tworzenia mikotoksyny wpływa wiele czynników, m.in. szczep grzyba. Tylko pewien procent izolatów danego gatunku wykazuje zdolność do tworzenia tego typu wtórnych metabolitów. Nie bez znaczenia pozostaje również rodzaj podłoża (jego skład chemiczny i obecność mikroelementów: cynku, magnezu, kobaltu) i warunki prowadzonej hodowli, np. wilgotność oraz temperatura.
Grzybom toksykotwórczym często towarzyszą też inne, nieszkodliwe dla nas gatunki, a ich obecność wpływa na ilość produkowanej mikotoksyny. Przykładowo grzyby z rodzaju Trichoderma wykazują działanie antagonistyczne obniżające ilość wtórnych metabolitów nawet do 95%.
Do najliczniej reprezentowanych gatunków toksykotwórczych zalicza się Penicillium i Aspergillus, czyli saprofity i tzw. grzyby przechowalnicze, rozwijające się po zbiorze płodów rolnych i ogrodniczych. Trzeci pod względem liczebności jest rodzaj Fusarium, który może rozwijać się zarówno na polach, jak i w magazynach.
Ze względu na częstość występowania i poziom powodowanych strat w produkcji zwierzęcej, wyróżnić należy pięć głównych grup mikotoksyn: aflatoksyny, ochratoksyna A, zearalenon, trichoteceny i fumonizyny.
Aflatoksyny
Budowę tych toksyn ustalono w 1963 r., czyli w trzy lata po masowym zatruciu indyków na angielskich farmach. Początkowo jednak aflatoksykozę uznawano jedynie za żywieniową chorobę drobiu.
Obecnie wyróżnia się sześć różnych aflatoksyn oznaczanych jako: B1, B2, G1, G2, M1 i M2. Najbardziej rozpowszechniona w płodach rolnych jest aflatoksyna B1, która w swojej cząsteczce zawiera układ atomów podobny do kumaryny – tzn. pierścień laktonowy połączony z benzenowym. Szkodliwość aflatoksyny B1 wynika również z obecności dwóch pierścieni furanowych, z których skrajny posiada wiązanie podwójne. Jego redukcja prowadzi do utworzenie aflatoksyny B2 wykazującej znacznie mniejszą toksyczność. Hydroksylowymi pochodnymi aflatoksyn B1 i B2 są aflatoksyny M1 i M2, natomiast aflatoksyna G1 różni się od B1 tym, że jej skrajny pierścień z ugrupowaniem ketonowym zawiera dodatkowy atom tlenu. Po redukcji skrajnego pierścienia furanowego tworzy się z niej aflatoksyna G2.
Aflatoksyna B1 w organizmie zwierząt stałocieplnych ulega unieczynnieniu. Reakcja ta polega ona na demetylacji związku i prowadzi do utworzenia aflatoksyny P1, która następnie wydalana jest razem z moczem jako uronid. Formą aktywną w organizmie zwierzęcym jest epoksyd aflatoksyny B1, który w wątrobie ulega utlenieniu przez cytochrom P450 tworząc w ten sposób aflatoksynę B1.
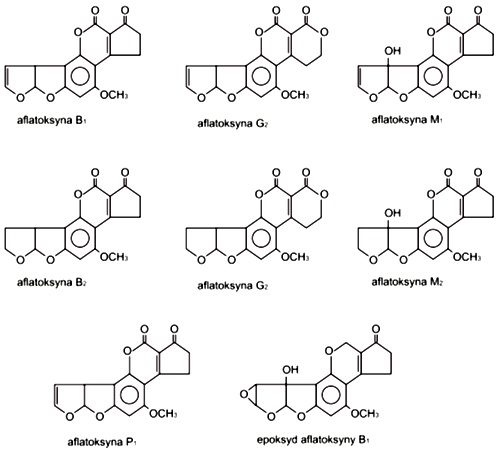
Rys. 2. Aflatoksyny
Do gatunków wytwarzających aflatoksyny należą przede wszystkim Aspergillus flavus Link i Aspergillus parasiticus Speare. Są one szeroko rozpowszechnione w glebie, magazynach oraz przechowywanych płodach rolnych.
Obecność aflatoksyn dotyczy bardzo wielu produktów, jednak największe znaczenie mają one w hodowli orzeszków arachidowych (ang. peanuts), bawełny oraz kukurydzy. Skażenia te stanowią poważny problem klimatu subtropikalnego i tropikalnego. Wpływa na to wysoka temperatura i wilgotność połączona z prymitywnymi warunkami zbioru i przechowywania oraz niskim poziomem edukacji rolniczej krajów rozwijających się.
Według zaleceń Światowej Organizacji Zdrowia (ang. World Health Organization – WHO) żywność przeznaczona bezpośrednio dla człowieka nie może zawierać wykrywalnych ilości aflatoksyn, które już przy bardzo małych stężeniach wykazują silne działanie mutagenne i teratogenne. W przypadku pasz, górna granica wynosi 20 μg/kg. Jednak już nawet w tak niewielkich ilościach związki te przyczyniają się do obniżenia odporności na choroby infekcyjne, zmniejszenia przyrostów wagowych drobiu, trzody i bydła oraz zwiększenia zużycia paszy na przyrost 1 kg masy ciała.
Nefrotoksyny
O tym, że żywienie trzody zapleśniałym ziarnem żyta wywołuje uszkodzenia nerek wiedziano już od 1928 r., jednak dopiero w 1973 r. objawy tzw. nefropatii powiązano z grzybowym metabolitem – ochratoksyną A.
Mikotoksyna ta jest peptydem aminokwasu L-fenyloalaniny, który poprzez grupę aminową połączony jest z kwasem izokumarynowym. Obecność grupy fenolowej wpływa na toksyczność ochratoksyny, a usunięcie fenyloalaniny lub jej zastąpienie innym aminokwasem znacznie zmniejsza szkodliwość tego związku.
Charakterystyczne dla ochratoksyny A jest występowanie w jej cząsteczce atomu chloru podstawionego w pierścieniu benzenowym. Związek niezawierający chloru, nazywany jest ochratoksyną B i charakteryzuje się znacznie mniejszą toksycznością.
Oba metabolity wytwarzane są przez te same gatunki grzybów – <em.Aspergillus ochraceus i Penicillium verrucosum, występujące powszechnie na przechowywanym ziarnie zbóż. Zakażenia te dotyczą głównie żyta i pszenicy, których podatność na zachorowanie zmienia się wraz z przynależnością do konkretnej odmiany. Zawartości toksyny w ziarnie wzrasta przeważnie wraz zanieczyszczeniem glebą, obecnością nasion chwastów oraz wysokim procentem nasion uszkodzonych. Główne straty powodowane są w rejonach o wysokiej wilgotności.
Ochratoksyny wywołują nieodwracalne uszkodzenia nefronów i z tego powodu są przyczyną dużych strat w produkcji zwierzęcej. Objawy zatrucia obejmują przede wszystkim zmniejszenie wagi, tempa wzrostu oraz wzmożone pragnienie, które w skrajnych przypadkach prowadzi nawet do śmierci. Wykazano również, że toksyny te wykazują działanie teratogenne oraz mają wpływ na wady rozwojowe płodu. Toksyna jest kumulowana w tkankach zwierząt, przez co może zagrażać również zdrowiu ludzkiemu. Wyjątek stanowią przeżuwacze – bydło i owce, u których nie obserwuje się ochratoksykozy.
Oprócz ochratoksyny A w paszach często obecna jest również inna nefrotoksyna – cytrynina, czyli pochodna benzopirenu. Grzybem powodującym równoczesne tworzenie się obydwu tych toksyn jest Penicillium verrucosum. Zdolność do tworzenia cytryniny wykazują także pozostałe gatunki grzybów z rodzaju Penicillium. Podobnie jak ochra toksyny, cytrynina ma kwaśny charakter determinowany obecnością wolnej grupy karboksylowej.
Pochodną cytryniny jest askoszytyna wywołująca nekrozę liści grochu oraz efekt membranowy. Jak dotąd nie poznano jeszcze jej właściwości zootoksycznych.
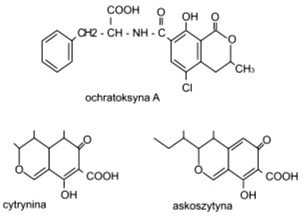
Rys. 3. Nefrotoksyny
Zaeralenon
Zearalenon to niesteroidowy mikoestrogen – jest metabolitem grzybowym o aktywności hormonalnej, a konkretnie estrogenicznej. Pod względem chemicznym mikotoksyna ta jest β-rezorcyno-laktonem, który w swojej cząsteczce, obok pierścienia rezorcynowego zawiera makrocykliczny pierścień laktonowy o układzie przestrzennym zbliżonym do układu hormonów sterydowych. Duży pierścień laktonowy zearalenonu jest bardzo trwały, przez co nie ulega hydrolizie, ani redukcji.
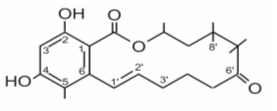
Rys. 4. Zaeralenon (ZEA)
Działanie ZEA jest kilka razy silniejsze niż w przypadku naturalnie występujących estrogenów. Związek ten już w niewielkich stężeniach wywiera stymulujące działanie na rosnące zarodki kukurydzy, natomiast u zwierząt powoduje zmiany funkcjonalne w układzie rozrodczym.
Wraz z krwią trafia do wątroby, gdzie ulega przekształceniu do nietoksycznego β- zearalenolu i α- zearalenonu wiążącego się z receptorami estrogenowymi nawet 10 do 20 razy silniej niż ZEA. Różnice we wrażliwości na tą mikotoksynę zależą od profilu metabolicznego zwierzęcia i są cechą charakterystyczną dla poszczególnych gatunków. Na ogół ZEA charakteryzuje się stosunkowo niską toksycznością ostrą, lecz mimo to przyczynia się do znacznych start ekonomicznych. Jego działanie jest najgroźniejsze w przypadku trzody chlewnej, gdyż znacznie obniża kosztowną reprodukcję. Szczególnie wrażliwe na zearalenon są młode maciorki. Wysokie stężenia ZEA (50-100 μg/kg) w diecie świń mają niekorzystny wpływ na zapłodnienie, owulację i zagnieżdżenie się jaja. Może być przerwany również rozwój błony łożyska i rozwój płodu, powodując zmniejszoną wielkość miotu i żywotność nowonarodzonych prosiąt. W przypadku bydła toksyczne właściwości tego związku są częściowo niwelowane dzięki obecności drobnoustrojów rozwijających się w przewodzie pokarmowym.
Hyperestrogenizm jest schorzeniem występującym przede wszystkim w krajach, w których ziarno kukurydzy stanowi główny ilościowo składnik paszy przeznaczonej dla trzody. Związane jest to ze specyfiką grzybów wytwarzających zearalenon: Fusarium graminearum, F. culmorom, F. cerealis i F. equiseti.
Niebezpieczeństwo rozwoju mikroorganizmów wzrasta w wyniku przechowywania zbóż w niewłaściwych warunkach. Magazynowane ziarno przeznaczone na pasze powinno być suche i dobrze oczyszczane.
Trichoteceny
Trichoteceny są metabolitami o charakterze epoksydów seskwiterpenowych wytwarzanymi głównie przez grzyby z gatunku Fusarium (Fusarium graminearum, F. culmorum, F. crookwellense, F. sporotrichoides, F. poae, F. acuminatrum). Do grupy tej zalicza się obecnie ok. 150 związków zawierających szkielet podstawowy 12, 13- epoksy – Δ 9 – trichotecenowy z podwójnym wiązaniem między 9 i 10 węglem.
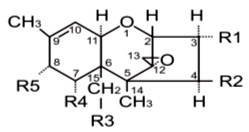
Rys. 5. Podstawowy pierwścień trichotecenowy
Ze względu na różne rodzaje podstawników łańcucha głównego trichoteceny dzieli się na cztery grupy:
• najbardziej toksyczne są metabolity grupy A (T-2 toksyna, HT-2 toksyna, diacetoksyscirpenol, neosolaniol i inne pochodne) zawierające łańcuch boczny przy węglu C5 i wywołujące zapalenia skóry (ang. skin irritating factor);
• trichoteceny grupy B w pozycji 8 mają podstawiony tlen i z tego powodu nazywane są również 8-ketotrichotecenami. Należą tu związki o charakterze polarnym i silnym działaniu wymiotnym: niwalenol, fuzarenon, deoksyniwalenol (DON = womitoksyna), diacetyloniwalenol. Są one jednak mniej toksyczne niż przedstawiciele grupy A;
• trichoteceny grupy C (werukaryny, rorydyny i satratoksyny) są to związki tzw. makrocykliczne, zawierające oprócz szkieletu trichotecenowego dodatkowy pierścień aromatyczny;
• grupa D obejmuje trichoteceny dwuepoksydowe takie jak krotecyna.
Najsilniejszymi toksynami wśród trichotecenów są toksyna T-2 i diacetoksyscirpenol (DAS), typowe dla krajów o chłodnym klimacie. W klimacie umiarkowanym lub subtropikalnym toksyny te występują najczęściej w kukurydzy.
Wachlarz objawów wywoływanych przez spożycie trichotecenów obejmuje głównie zaburzenia w funkcjonowaniu układu pokarmowego, tzn. wymioty, zapalenie jelit, utratę apetytu, zapalenie błon śluzowych, a w przypadku wyższych stężeń – ronienia, mumifikacje płodów oraz niepłodność.
Fumonizyny
Fumonizyny zalicza się do neurotoksyn, które uszkadzają szlak biosyntezy sfingozyny –sfingolipidu stanowiącego składnik mózgu i tkanki nerwowej. Powodują one również uszkodzenie funkcji nerek i wykazują działanie kancerogenne.
Jak dotąd poznano ponad piętnaście analogów fumonizyn, z których największe znaczenie mają kolejno fumonizyna B1, B2 i B3. Stanowią one grupę mikotoksyn o pokrewnej strukturze, a ich silna polarność przez długi czas nastręczała trudności przy ich izolacji i oczyszczaniu.
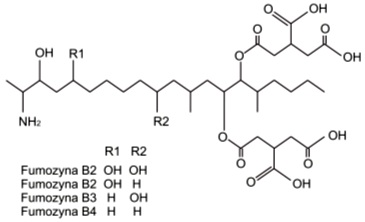
Rys. 6. Fumonizyny
Skażenie fumonizyną dotyczy głównie kukurydzy, gdyż jej struktura i wielkość oraz długi okres dojrzewania ziarniaków sprzyjają akumulacji szkodliwych związków i powstawaniu tzw. „różowej fuzariozy” nazywanej też suchą zgnilizną (ang. dry kernel rot). Związki te mogą także występować w ziarniakach oraz rdzeniach kolb bez objawów charakterystycznych dla fuzariozy.
Tego typu zakażenia występują na wszystkich kontynentach i we wszystkich regionach upraw. Transgeniczne odmiany odporne na żerowanie owadów wykazują mniejszą podatność na infekcję Fusarium verticillioides (Sacc.) Nirenberg, jednak ich stosowanie nie jest dozwolone w krajach Unii Europejskiej.
Patulina
W początkowym okresie badań nad patuliną znane były jej silne właściwości antybiotyczne i z tego powodu przypisywano jej wiele nazw: penicydyna, klawiformina, klawatyna, ekspansyna, kwas gigantowy. Wkrótce jednak okazało się, że ma ona silne działanie toksyczne, teratogeniczne i rakotwórcze. Związek ten stanowi bardzo dobry przykład szerokiego i różnorodnego działanie metabolitów grzybowych.
Pod względem chemicznym patulina jest dwupierścieniowym laktonem o nazwie 4- hydroksy-H-furo-3,2-c-piran-2/6H/-on.
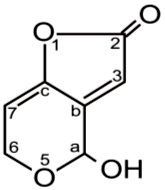
Rys. 7. Patulina
Obecnie wiadomo, że wytwarzają ją grzyby z gatunków Penicillium (głównie P. expansum wywołujący zgniliznę mokrą) i Aspergillus – saprofity rozwijające się przy wilgotności względnej 80-90%. Mogą one również rosnąć na pozostawionych pożniwnych szczątkach roślinnych i przyczyniać się do obniżenia plonów w następnym sezonie.
Patulina jest związkiem bardzo reaktywnym, który łatwo wchodzi w połączenia z białkami i kwasami nukleinowymi. Właściwość ta stanowi główną przyczynę szkodliwości dla organizmów żywych, z drugiej jednak strony pozwala też na szybkie unieczynnienie toksyny w żywności i paszach. Przedostawanie się patuliny przez przewód pokarmowy do organizmów zwierzęcych nie jest na ogół niebezpieczne. Jedynie jej wysokie stężenia prowadzą do zahamowania rozwoju mikroflory jelitowej.
Skażenie patuliną dotyczy wszystkich rodzajów surowców i produktów spożywczych: owoców, warzyw, ziarna zbóż, mięsa, serów, pieczywa. W największym stopniu odnosi się jednak do jabłek, gruszek, winogron oraz sporządzonych z nich soków. Zawartość patuliny w przetworach owocowych jest dobrym wskaźnikiem jakości surowca użytego do ich produkcji.
Zapobieganie powstawaniu mikotoksyn
Tworzeniu się mikotoksyn można zapobiegać dzięki stosowaniu:
1) prawidłowego wykonywania zabiegów agrotechnicznych obejmujących właściwą ochronę fitosanitarną upraw, zapobieganie inwazjom owadów, dobór odmian odpornych, staranny zbiór;
2) przechowywania plonów w warunkach uwzględniających cechy genetyczne oraz wymagania poszczególnych gatunków zbóż, owoców i warzyw, a także poziom uszkodzenia przez owady, zanieczyszczenia ziemią, kurzem, łodygami i liśćmi chwastów, które lokalnie zwiększają wilgotność plonów.
Całkowite wyeliminowanie zanieczyszczeń z płodów rolnych jest jednak niemożliwe i dlatego w niektórych przypadkach zaleca się stosowanie zabiegów mających na celu eliminację i unieczynnienie znajdujących się w nich mikotoksyn. Zabiegi te są często kosztowne, a także praco- i czasochłonne.
W procesie tłocznia roślin oleistych toksyny pozostają głównie w śrucie i jedynie w nieznacznym stopniu przechodzą do frakcji olejowej. Z tego powodu opracowano przemysłowe metody rozkładu aflatoksyn polegające na traktowaniu śruty gazowym amoniakiem pod ciśnieniem. Metoda ta powoduje jednak rozkład niektórych aminokwasów. W przypadku aflatoksyn alternatywą jest ekstrakcja z użyciem polarnych rozpuszczalników takich jak etanol oraz ekstrakcja benzynowa. Po tym procesie możliwe jest odzyskanie dużej ilości rozpuszczalnika. Orzeszki ziemne sortuje się ręcznie lub maszynowo jeszcze przed ich przerobem. Ziarna kukurydzy traktuje się natomiast amoniakiem gazowym lub wodą amoniakalną w temperaturze pokojowej. Choć proces ten trwa kilka tygodni, to nie zmniejsza w znaczny sposób wartości paszowej ziarna.
Procesom unieczynnienia warto poddawać jedynie znacznie zanieczyszczone surowce, które często rozcieńcza się składnikami wolnymi od toksyn i w ten sposób uzyskuje poziom skażenia nieszkodliwy dla zwierząt. Takiej paszy nie należy jednak podawać osobnikom młodym i ciężarnym, a także karmiącym i mlecznym krowom.
Oznaczanie zawartości mikotoksyn
Mikotoksyny występują w produktach spożywczych i w paszach w bardzo niewielkich ilościach. Ich analizy oparte są na właściwościach fizykochemicznych związków i przebiegają w trzech etapach:
• ekstrakcji, najczęściej chloroformem lub acetonitrylem;
• oczyszczania ekstraktów z zanieczyszczeń przeszkadzających w analizie;
• oznaczania jakościowego i ilościowego, z wykorzystaniem chromatografii cienkowarstwowej, gazowej lub wysokosprawnej chromatografii cieczowej. Powszechnie stosuje się także metody oznaczania oparte na teście ELISA. Do badań nad ochratoksyną A obecną w krwi i tkankach zwierząt można stosować również metodę spektrofluorometryczną.
Ocena toksyczności metabolitów grzybowych
Analizą szkodliwości mikotoksyn dla zwierząt domowych i laboratoryjnych zajmują się naukowe placówki medyczne i weterynaryjne. Ich zadaniem jest wyznaczanie progów szkodliwości mikotoksyn zawartych w żywności i paszach. Kiedy próg ten zostanie przekroczony, następuje akumulacja toksyn w wątrobie, nerkach i mięśniach. Szkodliwe związki przechodzą do mleka i jaj, co stwarza zagrożenie dla zdrowia konsumenta. Jedynie małe ilości mikotoksyn mogą być bez szkody metabolizowane, unieczynniane i wydalane wraz z moczem.
Ocenę toksyczności metabolitów grzybowych przeprowadza się głównie na zarodkach jaj kurzych lub zwierzętach laboratoryjnych (m.in. kaczętach, kurczętach, myszach, szczurach, świnkach morskich), które karmi się zakażoną paszą, a następnie poddaje się ocenie ich stan zdrowotności. Dokładniejsze analizy przeprowadza się jedynie w przypadku zaobserwowania spadku przyrostu ciała lub innych objawów chorobowych. Wyznacza się wtedy śmiertelną dawkę toksyny, a następnie analizuje zmiany wywołane przez nią w różnych narządach. Na podstawie długoterminowych badań toksykologicznych ustala się dopuszczalne zawartości poszczególnych toksyn w żywności i paszach, takie jakie mogą być spożywane bez obawy o zdrowie człowieka i zwierząt.
Opracowano również prostsze i tańsze laboratoryjne testy biologiczne z wykorzystaniem larw krewetek Artemia salina, bardzo czułych na obecność mikotoksyn. Metoda ta znajduje zastosowanie również w przypadku mikotoksyn o nieustalonej budowie i pozwala na uzyskanie wyników już po 24 godzinach.
Autor: Anna Kurcek
Literatura:
1. Chełkowski J.. Mikotoksyny, grzyby toksykotwórcze i mikotoksykozy. wersja on-line: www.cropnet.pl/mycotoxin.
2. Agrios G. N., 2005. Plant Pathology. Elsevier Academic Press.
3. Jarzynka S., Dąbkowska M., Netsvyetayeva I., Swoboda-Kopeć E., 2010.
4. Mikotoksyny – niebezpieczne metabolity grzybów pleśniowych. Medycyna Rodzinna 4: 113-119.
5. Kawa-Rygielska J., 2009. Jednoczesna identyfikacja trichotecenów typu A i B oraz zearalenonu w produktach kukurydzianych. Żywność. Nauka. Technologia. Jakość 6 (67): 112-118.
6. Mroczek I., 2009. Szkodliwość mykotoksyn w paszach dla świń. WODR Poznań. wersja on-line: http://wodr.org.

