Autor: Paweł Krzyżek
Większość badań dotyczących sposobów żywienia nie zakłada, że między ludźmi występują różnice w potrzebach racji żywieniowych. Najczęściej dostrzega się istnienie takich rozbieżności tylko na osi: dzieci-dorośli, zdrowi-chorzy, wysoka-niska aktywność fizyczna. Nowocześniejsze podejście uwzględnia prócz wieku czy aktywności, także płeć, wzrost oraz masę ciała. Kolejnym krokiem w stronę personalizacji potrzeb jest nutrigenetyka. Jest to nauka, która zajmuje się analizą międzyosobniczych oraz międzypopulacyjnych odmienności genetycznych, które przekładają się na różnice w reakcji na składniki diety.
Środowisko, a w tym również substancje odżywcze, mają zdolność wpływania na genotyp ludzki oraz kształtowania fenotypu. Złożoność i różnorodność organizmów powoduje, że ustalenie działania czynników środowiskowych jest zadaniem bardzo trudnym. Nie każde odchylenia od normy oznaczają od razu stan patologiczny i mogą być jedynie krótkotrwałą reakcją fizjologiczną.
Podstawowym zadaniem, którym zajmuje się nutrigentyka jest identyfikacja polimorfizmów pojedynczych nukleotydów (SNP). SNP to jednonukleotydowe substytucje w łańcuchu DNA. Wielopostaciowość wariantów genetycznych determinuje odmienną odpowiedź metaboliczną na bioaktywne składniki diety. Zróżnicowanie odpowiedzi na substancje prowadzi ostatecznie do konieczności zbilansowania menu żywieniowego. Podsumowując, celem nutrigenetyki jest określanie różnic wariantów genetycznych i ich wpływu na metabolizm osobniczy. Ludzki genom zawiera ponad 3 mld par zasad, z czego około 10 mln to SNP. Można łatwo dostrzec jak duży wpływ na metabolizm mają polimorfizmy genów. Zmienność ta jest efektem wystawienia na niekorzystne warunki środowiskowe, a kiedy mutacje – w tym przypadku SNP, okażą się korzystne, zostaną przekazane dalszemu pokoleniu i rozprzestrzenią się.

Polimorfizm pojedynczego nukleotydu – SNP (źródło: http://www.siriusgenomics.com).
Przykładem jednonukleotydowego polimorfizmu jest gen reduktazy metylenotetrahydrofolianowej (MTHFR). Związek ten jest niezbędny jako donor grup metylowych w reakcji przekształcenia homocysteiny w metioninę. Polimorfizm polega na substytucji cytozyny na tyminę (C667->T), a to przyczynia się do pogorszenia zdolności katalitycznych tego enzymu. Homozygoty TT posiadają zwiększoną ilość homocysteiny oraz zmniejszoną metioniny. Ta ostatnia stanowi źródło S-adenozylometioniny, która jest konieczna przy metylacji wysp CpG oraz białek histonowych. Skutkiem jest zwiększona możliwość wystąpienia zespołu Downa lub nowotworów szyjki macicy, ale zmniejszona podatność na inne nowotwory np. odbytu i jelita grubego.
Bioaktywne składniki diety to molekuły które są egzogennymi nośnikami informacji i mają zdolność decydowania o ilościowej i jakościowej ekspresji genów. Ich działanie opiera się na regulacji aktywności receptorów jądrowych oraz struktury chromatyny.
Warunkiem koniecznym interakcji między bioaktywnym składnikiem a jądrem komórkowym jest utworzenie kompleksu receptora jądrowego. W tej formie ligand i receptor warunkują kondensację lub rozplecenie chromatyny, zależnie od tego czy ligand jest represorem, czy aktywatorem. Receptory klasyczne reagują z bioaktywnymi składnikami o dużej analogii strukturalnej. Takim przykładem są receptory androgenów i estrogenów aktywowane przez izoflawonoidy soi. Receptory sensorowe cechuje możliwość łączenia z szerokim wachlarzem substancji, ale konsekwencją tego jest niskie powinowactwo. Przykładem są receptory aktywowane proliferatorem peroksysomów (PPAR), aktywowane kwasami tłuszczowymi, witaminami, herbicydami, toksynami czy substancjami rakotwórczymi. PPAR odpowiadają za metabolizm lipidów, cholesterolu, leków czy kancerogenów, stąd ich zdolność do łączenia się z szeroką gamą ligandów.
Drugą możliwością po regulacji receptorów jądrowych, jest bezpośredni wpływ na organizację chromatyny lub modyfikację białek histonowych. Zmiany epigenetyczne nie są kodowane przez DNA, ale mogą być przekazywane potomnym i mają zdolność wpływania na wyciszenie lub aktywację ekspresji genów. O aktywności decydują takie procesy jak acetylacja/deacetylacja, fosforylacja, sumoilacja, ubikwitynacja, glikozylacja, ADP-rybozylacja, ale najistotniejszym jest metyzacja/demetylacja.
Wyspy CpG (odcinki DNA z reguły niemetylowane) oraz N-końcowe ogony histonowe stanowią główny cel regulacji transkrypcji. Zmetylowanie spowoduje powstanie chromatyny skondensowanej, nieaktywnej, niedostępnej dla czynników transkrypcyjnych. Demetylacja rozluźnia strukturę chromatyny i daje efekt odwrotny do poprzedniego. Nieprawidłowości w działaniu tych procesów polegają na hipometylacji, która nie wycisza odpowiedniej ilości genów i możne przyczynić się do aktywacji nowotworów, lub hipermetylacji, przyczyniającej się do zbyt intensywnego hamowania ekspresji. Rolą metylacji, prócz podstawowej regulacji transkrypcji, jest również ochrona genomu przed transpozonami czy endogennymi sekwencjami wirusowymi.
Dieta w znaczny sposób oddziałuje na epigenetykę. Nieprawidłowy przebieg mechanizmów epigenetycznych może skutkować stresem oksydacyjnym, otyłością, insulinoopornością, cukrzycą oraz problemami z układem naczyniowo-krążeniowym. Wynika to z aktywacji genów, które w warunkach fizjologicznych powinny być wyciszone lub braku aktywacji genów potrzebnych organizmowi.
Epigenetyczna regulacja genów przy pomocy RNA zachodzi na poziomie post-translacyjnym oraz na poziomie chromatyny. Za mechanizmy te odpowiada piRNA oraz miRNA, które należą do grupy RNA niekodujących. Warunkują natomiast metylację DNA i histonów, oraz determinują wyciszenie lub wzmocnienie ekspresji genów. Rolą piRNA jest metylacja ruchomych transkryptów np. transpozonów oraz podtrzymywanie linii zarodkowych komórek macierzystych. Zadaniem miRNA jest regulacja ekspresji genów na poziomie post-translacyjnym. Zbyt wysoki poziom miRNA powoduje represję translacji w tkankach i jest często związany z rozwojem chronicznych przypadłości. Modulowanie jego aktywności może okazać się kluczowym w prewencji syndromu metabolicznego.
Modelem badawczym w określaniu wpływu diety na epigenetykę są myszy aguti. Gen warunkujący żółte zabarwienie ich futerka zwiększa jednocześnie wrażliwość na choroby nowotworowe oraz otyłość. Przy diecie o podwyższonej ilości donorów grup metylowych np. witaminy B12 oraz kwasu foliowego, zauważono brązowienie futerka myszy oraz normalizację wagi.
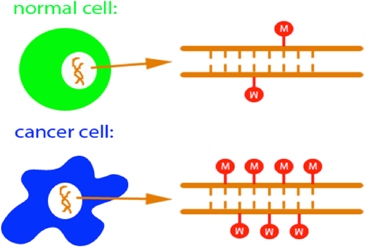
Rys.2. U góry przedstawiona jest zdrowa komórka, ze standardowo zmetylowanym DNA, na dole wyciszona komórka nowotworowa o zwiększonej metylacji DNA (źródło: http://www.ks.uiuc.edu).
Badanie takie jak to pokazuje, że SNP mogą determinować predyspozycje do przypadłości takich jak otyłość. Spersonalizowanie porad żywieniowych mogłoby w znaczący sposób polepszyć wyniki redukcji masy. Gromadzenie tkanki tłuszczowej wynika z dostarczania nadmiernej ilości kalorii w stosunku do ilości wydatkowanej. Jednak nie ma wątpliwości, że nie u wszystkich z nadpodażą kalorii rozwija się nadwaga, i nie wszyscy z otyłością spożywają wysoko kaloryczną żywność. Ocenia się, że polimorfizmy genetyczne oraz inne uwarunkowania genetyczne aż w ponad 50% determinują takie predyspozycje. Prawdopodobnie istnieją także geny oporności na otyłość.
Gen FTO, określony został przez naukowców genem otyłości. Jego aktywność warunkuje cechy budowy ciała objawiające się zwiększeniem BMI i obwodu talii, ale także cechy fizjologiczne jak zwiększenie przyjmowania ilości kalorii oraz zmniejszenie uczucia sytości.
Wśród przykładów SNP podaje się polimorfizm Pro12Ala PPARγ2, gdzie mutacja (CCA->GCA) skutkuje zmianą proliny na alaninę. To przyczynia się do wzmożonej predyspozycji do zachorowania na otyłość oraz zaburzeniami gospodarki węglowodanowej. Genotypem „dzikim”, najczęściej występującym jest Pro12Pro.
Nadmiar tkanki tłuszczowej jest jednym z najważniejszych czynników syndromu metabolicznego. Istotność tej tkanki wynika z silnego działania endokrynnego, a większość substancji tu produkowanych to czynniki prozapalne. Nadmiar tłuszczu równa się nadprodukcji tych substancji, a to bardzo negatywnie wpływa na funkcjonowanie organizmu.
Przez żywność funkcjonalną rozumiemy środki spożywcze o zwiększonej ilości korzystnych substancji bioaktywnych lub zmniejszonej ksenobiotyków – związków kancerogennych czy toksyn. Zadaniem takich produktów spożywczych jest polepszenie jakości zdrowotnej: łatwiejsze trawienie, wzmocnienie układu immunologicznego czy zapobieganie bezpośrednio rozwojowi chorób.
Witaminy oraz minerały pełnią przede wszystkim funkcje katalityczne lub stanowią komponenty metaloprotein. Mikro- i makropierwiastki nie mogą być syntezowane w ciele człowieka, dlatego muszą być egzogennie dostarczane w codziennej diecie. Witaminy z kompleksu B oraz witamina C są rozpuszczalne w wodzie, dlatego ich ilość nie utrzymuje się długo w organizmie i istnieje konieczność codziennego dostarczania ich w pożywieniu. Witaminy A, D, E, K są natomiast rozpuszczalne w tłuszczach, to też organizm potrafi kumulować pewne ich ilości i w okresach zwiększonego zapotrzebowania może korzystać z tego rezerwuaru. Pierwiastki odpowiadają za ciśnienie osmotyczne oraz buforują pH.
Pośród mikro- i makroelementów, które mają zdolność wpływania na genom ludzki wymienia się magnez (udział w naprawie i replikacji DNA), wapń (hamuje pęknięcia chromosomów), selen (warunkujący odpowiednie zmetylowanie), mangan oraz miedź.
Witaminy charakteryzują się szerszym spektrum działania w ochronie genomu. Witaminy A, C oraz E jako przeciwutleniacze chronią zasady nukleinowe przed utlenieniem. Zadaniem niacyny jest utrzymywanie odpowiedniej struktury telomerów. Witamina B12 i kwas foliowy stanowią źródło donorów grup metylowych. To umożliwia ochronę przed nowotworami, ale warunkuje także większą protekcję np. przed wirusem HIV, zapobiegając wiązaniu się retrowirusa do genomu i hamując aktywność integrazy HIV.
Kwasom tłuszczowym przypisuje się bardzo często jedynie rolę w gospodarce energetycznej oraz budowie błon komórkowych. Ważnym zadaniem jest również acetylacja i sortowanie białek, a te wchodzą w skład enzymów oraz receptorów, różnicowanie komórek czy udział w reakcjach odpornościowych przez produkcję wielu czynników prozapalnych. Działanie kwasów tłuszczowych zależy od liczby wiązań podwójnych oraz miejsca, w którym jest ono ustawione, oraz długości łańcucha węglowego.
Wielonienasycone kwasy tłuszczowe są naturalnymi ligandami receptorów PPAR, dzięki czemu mają zdolność regulowania wielu procesów metabolicznych. Kwasy tłuszczowe PUFA n-3 dzięki łączeniu się z PPARα obniżają poziom trójglicerydów oraz podnoszą poziom HDL. Zwiększenie ich ilości przynosi odwrotnie proporcjonalną, ujemną korelację na działanie czynników prozapalnych. Komórki nowotworowe mogą ulec skutecznie destrukcji przez działanie kwasów PUFA n-3, ponieważ PPARγ ulegają tam silnej ekspresji. Kwasy tłuszczowe, będąc ligandami łączą się z tymi receptorami i hamują wzrost onkogennych komórek.
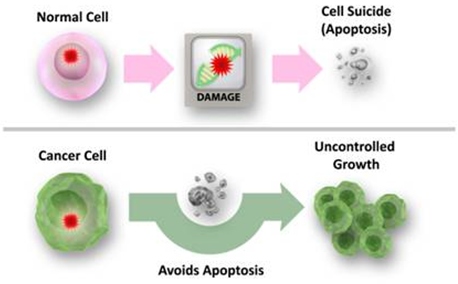
Rys.3. U góry przedstawiony prawidłowy mechanizm: sprawnie działający system kontrolny wyeliminował komórkę z mutacją/uszkodzeniem, na dole: brak sprawnego systemu, uniknięcie apoptozy i niekontrolowany podział komórek nowotworowych (źródło: http://www.cancer.gov).
Kwasy tłuszczowe przynoszą silne korzyści zdrowotne, ale jedynie dla części populacji. Efekt jest zauważalny u nosicieli alleu Pro12 PPARγ, u nosicieli allelu Ala12 kwasy tłuszczowe akumulują w tkance tłuszczowej, a ich działania nie da się zaobserwować.
Związki naturalnego pochodzenia stanowią bogate źródło bioaktywnych składników diety. Związkami takimi są fitosterole, czyli II-rzędowe alkohole sterydowe. Ich działanie opiera się na redukcji ilości LDL, a przez to zmniejszeniu jego absorpcji. To przyczynia się do obniżenia ilości zachorowań na choroby naczyniowo-krwionośne. Odpowiedź organizmu na te związki jest różna, zależna od predyspozycji międzyosobniczych i najprawdopodobniej warunkowana przez wiele genów. Kolejną klasą związków są naturalne przeciwutleniacze, czyli flawonoidy. Substancje te odpowiedzialne są za regulowanie aktywności metylotransferazy DNA, enzymu przenoszącego grupy metylowe.
Przykładem związku o bardzo silnym działaniu protekcyjnym na komórki jest resweratrol, pochodzący z rodziny sirtuin. Obniża poziom LDL, podwyższając jednocześnie HDL, działa przeciwzapalnie i przeciwmiażdżycowo. Niestety cechuje go niska bioaktywność, ponieważ wchłania się w małych ilościach w organizmie ludzkim.
Działanie związków pochodzenia naturalnego prowadzi do spowolnienia cyklów komórkowych, to zaś warunkuje wzmożenie kontroli na każdym poziomie tworzenia komórek potomnych, zwiększenie naprawy DNA, zapobieganie mutacjom oraz umożliwienie przeprowadzenia apoptozy – kontrolowanej śmierci komórkowej, jeśli w trakcie podziałów wykryte zostaną błędy.
Epidemiologiczne badania na zwierzętach ukazały bliską zależność między odżywianiem matki w trakcie trwania ciąży, a piętnem metabolicznym, którym zostaje naznaczone potomstwo. Przekazywanie informacji genetycznej potomnym odbywa się zarówno w postaci DNA, jak i kodu histonowego.
Wiele chronicznych chorób potomstwa ujawnia się dopiero w dorosłym wieku, nierzadko wywołane hiper- lub hipowitaminozą w trakcie ciąży matki. Oczywistym wydaje się fakt, że do prawidłowego rozwoju płodu wymagany jest odpowiedni zestaw węglowodanów, tłuszczy, białek, witamin oraz minerałów. Pobór składników odżywczych przez płód zależy jednocześnie od przepływu krwi, jak również koncentracji substancji, w krwi tętniczej i żylnej. Główne źródło energii dla płodu stanowią glukoza, aminokwasy oraz kwasy tłuszczowe. Wydatki poświęcane są na procesy fizjologiczne płodu tzn. transport składników odżywczych, wzrost ilości komórek oraz drogi biosyntetyczne.
Aminokwasy są nie tylko budulcem białek, ale także służą jako prekursory do syntezy istotnych związków np. hormonów, neurotransmiterów, kreatyniny, karnityny i poliamin. Dlatego bardzo ważnym jest, aby podaż tych związków była odpowiednia. Przyczyni się to do optymalnego wzrostu i rozwoju płodu. Prócz tego niektóre z aminokwasów pełnią kluczową rolę jako donory grup metylowych, wpływając na ekspresję genów, i są to glicyna, histydyna, metionina i cysteina.
Syndrom metaboliczny może być definiowany jako zespół przypadłości, na które składają się otyłość, hiperinsulemia, hiperlipidemia, hiperglikemia oraz nadciśnienie.
Stosowanie wysokotłuszczowej diety w czasie ciąży stymuluje dysfunkcje układu krążeniowego. Zauważono różnice w reakcji, między płodami dziewczynek i chłopców w trakcie żywienia matki wysokotłuszczowymi posiłkami. Dziewczynki okazały się być bardziej wrażliwe na zmiany ciśnienia płynącej krwi. Różnicę tą tłumaczy się w odmiennej sekrecji hormonalnej, zależnej od płci płodu.
Hipometylacja zwiększa ryzyko otyłości. Dieta matki bogata w tłuszcze zwiększa procent hipometylacji DNA w mózgu płodu, co ma swoje odzwierciedlenie w poziomie ekspresji genów oraz zachowaniu dziecka. Prowadzi do zwiększone ryzyka chorób neurodegeneracyjnych.
S-adenozynometionina stanowi źródło grup metylowych. Jest wymagana do syntezy poliamin, cysteiny, tauryny oraz kreatyniny. Jeśli w diecie występuje niedobór cysteiny lub tauryny, ich synteza z metioniny wzrośnie, obniżając tym samym zasób S-adenozynometioniny i ochronę DNA oraz metylację białek.
Z drugiej strony nadmiar substancji odżywczych również niesie za sobą poważne konsekwencje. Nadmiar niektórych witamin, a zwłaszcza przyjmowanych w postaci suplementów, w przypadku dłuższego stosowania może wyrządzić wiele szkód. Przykładem jest nadpodaż spożycia kwasu foliowego, która może redukować cytotoksyczność komórek NK. Co więcej, kwas foliowy wchodzi w interferencję z enzymami zależnymi od witaminy B12, a to może skutkować anemią, a w przypadku płodu programowaniem insulinooporności i otyłości.
Nie ulega wątpliwości, że osobnicze predyspozycję mają ogromny wpływ na odpowiedź organizmu na składniki pokarmowe. Mapowanie SNP może w niedługim czasie stać się podstawową formą badań nad określaniem ryzyka rozwoju chorób. Sposób odżywiania i farmakologia mogą stanowić nieodzowny element terapii w leczeniu przypadłości oraz stresu metabolicznego. W tym miejscu postawione zostaje zadanie dla nutrigenetyki. Miejmy nadzieję, że przyszłość przyniesie wiele skutecznych narzędzi, które posłużą do uzyskania informacji na temat zależności między jakością spożywanego pokarmu a stanem zdrowotnym człowieka. Leczenie pacjentów będzie skuteczniejsze, a okres rekonwalescencji znacznie krótszy.
Literatura:
1. Koziołkiewicz M. (2009) ,,Koncepcje nutrigenomiki” Biotechnologia 4, 87, 9-34.
2. Kolackov K. i wsp. (2010) ,,Wpływ polimorfizmów genu FTO na ryzyko otyłości” Endokrynologia, Otyłość i Zaburzenia Przemiany Materii 6, 2, 101-107.
3. Pieszka M., Pietras M. P. (2010) ,,Nowe kierunki w badaniach żywieniowych – nutrigenomika” Rocz. Nauk. Zoot. 37, 2, 83–103.
4. Panczyk M. (2013) ,,Nutrigenetyka i nutrigenomika – zastosowanie technologii ,,omics” w optymalizacji żywienia człowieka” Pediatric Endocrinology, Diabets and Metabolism 19, 2, 70-77.
5. Białek-Dratwa A. i wsp. (2013) ,,Nutrigenomika – bioaktywne składniki diety” Postępy Hig Med Dosw (online) 67, 255-260.
6. Adamska E., Ostrowska L. (2010) ,,Nutrigenetyka i nutrigenomika a leczenie otyłości i chorób towarzyszących” Forum Zaburzeń Metabolicznych 1, 3, 156–167.
7. Bazer F. W. et al. (2012) ,,Nutrition, Epigenetics, and Metabolic Syndrome” Antioxid Redox Signal. 17, 2, 282–301.

