W 1953 roku S. Robinson odkrył istnienie rybosomów, czyli struktur komórkowych uczestniczących w produkcji białek. Ich zawartość w komórce zależy od jej aktywności metabolicznej i może wynosić nawet do 25% całkowitej masy.
Rybosomy przypominają wyglądem „spłaszczone grzybki”, a od cytoplazmy nie oddziela ich żadna błona komórkowa. W rzeczywistości jednak ich struktura jest bardziej skomplikowana. Po raz pierwszy kształt rybosomu udało się zrekonstruować dzięki zastosowaniu mikroskopii elektronowej. Lokalizację miejsc aktywnych, znajdujących się na jego powierzchni, umożliwiło użycie mikroskopii immunoelektronowej z wykorzystaniem swoistych przeciwciał.
U organizmów prokariotycznych rybosomy tworzą się w cytoplazmie w wyniku prostego gromadzenia się poszczególnych komponentów.
U Eucaryota synteza rybosomów jest procesem bardziej skomplikowanym i zachodzi w jąderku, gdzie rRNA łączy się z odpowiednimi białkami. W wyniku tych procesów tworzą się kompleksy rRNA-białko, które można nazywać pierwotnymi podjednostkami. Zanim jednak znajdą się one w cytoplazmie, poddawane są kilkustopniowej procedurze dojrzewania. Po jej przejściu, już jako gotowe podjednostki, wędrują do cytoplazmy i dopiero tu łącza się ze sobą tworząc kompletny rybosom.
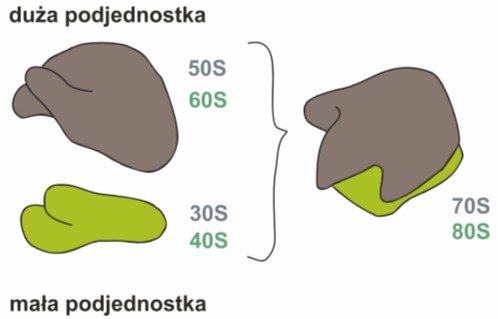
Rys. 1. Rybosom składa się z dwóch, różniących się od siebie podjednostek: dużej (60S u Eucaryota lub 50S u Procaryota) oraz małej (40S u Eucaryota lub 30S u Procaryota)
Każdy kompletny rybosom składa się większej i mniejszej podjednostki. Ze względu na ich wielkość wyróżnia się:
• rybosomy małe – występujące u organizmów prokariotycznych oraz w eukariotycznych plastydach i mitochondriach. Nie są one związane z błonami plazmatycznymi i występują jako zawieszone w cytoplazmie struktury. Ich masa wynosi średnio 2,5 x106 Da. Większa podjednostka ma stałą sedymentacji Svedberga 50S, a w jej skład wchodzą następujące komponenty: 23S rRNA, 5S rRNA oraz 34 białka oznaczone od L1 do L34. Mniejsza podjednostka 30S zbudowana jest z 16S rRNA oraz 21 białek. Stała sedymentacji Svedberga jest to współczynnik określający szybkość poruszania się cząstek koloidalnych pod wpływem sił odśrodkowych w ultrawirówkach. Odzwierciedla on stosunek gęstości struktury nie zaś jej masę i dlatego obie podjednostki tworzą razem rybosomy 70S.
• rybosomy duże – występują w cytoplazmie komórek eukariotycznych i z tego powodu zwane są również rybosomami typu eukariotycznego. Są one zwykle związane z błonami retikulum endoplazmatycznego szorstkiego i rzadko występują w cytoplazmie jako wolne organelle. Ich masa wynosi około 4,8 x 106 Da. Większa podjednostka ma stałą sedymentacji 60S i zawiera 5S rRNA, 5,8S rRNA, 28S rRNA oraz 50 swoistych polipeptydów. Mniejsza podjednostka – 40S zbudowana jest z 18SrRNA oraz około 30 łańcuchów polipeptydowych. Cały rybosom ma stałą sedymentacji 80S.
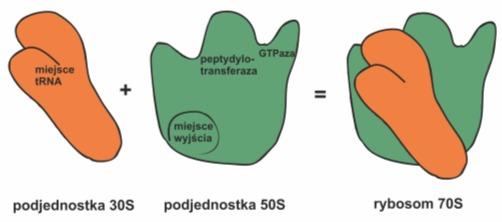
Rys. 2. Podjednostka 30S małego rybosomu zawiera miejsce wiązania tRNA. Ulokowane jest ono w szczelinie znajdującej się pomiędzy jej górną, a dolną częścią. Jednostka 50S posiada centrum peptydylotransferazowe katalizujące tworzenie wiązania peptydowego oraz centrum GTPazowe, napędzające przesuwanie się mRNA i tRNA. Tworzący się łańcuch polipeptydowy wynurza się po przeciwnej stronie podjednostki 50S.
Pod względem chemicznym rybosomy składają się z dwóch składników: rybosomalnego RNA (rRNA) oraz białek. Przez wiele lat uważano, że główną rolę podczas translacji odgrywają białka, natomiast rRNA tworzy jedynie szkielet strukturalny. Kwasy rybonukleinowe stanową około 2/3 całkowitej masy cząsteczki i tworzą w przestrzeni ściśle określone struktury zawierające kilka krótkich rejonów heliakalnych. Dopiero odkrycie katalitycznych właściwości RNA uzmysłowiło naukowcom, jak ważną rolę pełni ono w funkcjonowaniu rybosomów, które nawet pozbawione białek mogą nadal katalizować tworzenie wiązań peptydowych. Większość antybiotyków wpływających na syntezę polipeptydów oddziałuje specyficznie właśnie z rRNA. Przykładowo, sekwencja nukleotydowa 16S rRNA jest odpowiedzialna za wybór miejsca „start” na rybosomie, a hydroliza jednego znajdującego się w niej wiązania całkowicie hamuje proces translacji.
Praktycznie wszystkie cząsteczki rybosomalnego RNA pochodzą z pojedynczej prekursorowej cząsteczki 45S rRNA, ulegającej przekształceniom na terenie jądra komórkowego. Jedynie eukariotyczne 5S rRNA posiada swoją własną cząsteczkę prekursorową, przepisywaną niezależnie od reszty składników.
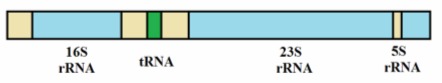
Rys. 3. Pierwotny transkrypt E. coli. Jego rozcięcie prowadzi do uwolnienia cząsteczek 5S, 16S i 23S rRNA oraz tRNA. Regiony rozdzielające (ang. spacer) oznaczono kolorem beżowym.
Rybosomy mogą występować pojedynczo lub zbierać się w polisomy, czyli zespoły współpracujące przy tłumaczeniu jednej cząsteczki mRNA. Wchodzą one w skład szorstkiej siateczki śródplazmatycznej i służą do syntezy białek przeznaczonych na eksport oraz budujących wewnątrzkomórkowe błony. Struktury polisomalne mogą także występować w wolnej postaci i być zawieszone w cytoplazmie. W tym stanie syntetyzują one białka pozostające we wnętrzu komórki.
Autor: Anna Kurcek
Literatura:
• Waldemar Lewiński, Jolanta Walkiewicz „Biologia 1 Podręcznik dla klasy pierwszej liceum ogólnokształcącego ”Wydawnictwo OPERON 1998;
• Robert K. Murray, Deryl K. Granner, Peer A. Mayes, Victor W. Rodwell “Biochemia Harpera” Wydanie II, Wydawnictwo Lekarskie PZWL, Warszawa 1995;
• Lubert Stryer „Biochemia” Wydawnictwo Naukowe PWN, Warszawa 2003.

