Powstawanie brodawek korzeniowych u roślin wyższych jest wynikiem ich symbiozy z bakteriami zdolnymi do wiązania azotu atmosferycznego, należącymi do czterech rodzajów wolno żyjących, ściśle tlenowych, gramujemnych pałeczek: Rhizobium, Bradyrhizobium, Azorhizobium, Sinorhizobium, określanych wspólnym mianem – rizobia. Bakterie te rozróżniane są na podstawie homologii sekwencji kwasów nukleinowych, szybkości wzrostu, produkcji kwasów z węglowodanów, serologii i specyficzności wobec gospodarza roślinnego.
Rośliny wchodzące w symbiozę z rizobiami należą wyłącznie do rodziny motylkowych (Leguminosae = Fabaceae), a jedynym znanym wyjątkiem jest zaliczany do wiązowatych (Ulmaceae) rodzaj Parasponia. Wodne rośliny motylkowe z rodzaju Sesbania, tworzą brodawki innego rodzaju, tj. brodawki łodygowe.
Dany gatunek lub szczep rizobiów indukuje specyficznie powstawanie brodawek u określonych roślin, dlatego symbioza ta jest oddziaływaniem swoistym, w którym gospodarz roślinny dostarcza informację genetyczną warunkującą wytworzenie brodawki, a mikrosymbiont bakteryjny uruchamia jego specyficzny program rozwojowy. Ponadto partner roślinny kontroluje inicjację brodawkowania i rozwój brodawek. Przykłady specyficznych oddziaływań:
Rhizobium meliloti – lucerna (Medicago),
Rhizobium leguminosarum biovar viciae – groch ( Pisum), wyka ( Viciae),
Rhizobium leguminosarum biovar trifolii – koniczyna ( Trifolium),
Rhizobium leguminosarum biovar phaseoli – fasola ( Phaseolus),
Rhizobium sp. NGR 234 – motylkowe strefy tropikalnej, Parasponia,
Bradyrhizobium japonicum – soja ( Glycine),
Azorhizobium caulinodans – Sesbania,
Sinorhizobium fredii – soja ( Glycine).
Nawiązanie symbiozy może nie być możliwe z powodu różnic genetycznych pomiędzy szczepami bakterii lub odmianami roślin. Dlatego symbiotyczne populacje roślinne dzieli się na:
– niewyspecjalizowane pod względem symbiotycznym (ang. symbiotic generalistis), wchodzące w symbiozę z większością szczepów danego gatunku bakterii;
– wyspecjalizowane symbiotycznie (ang. symbiotic specialists), nawiązujące symbiozę tylko z wybranymi szczepami.
Wśród bakterii wyróżnia się natomiast: – szczepy o tzw. szerokim zakresie gospodarza (ang. broad host range), zakażające większość populacji danego gatunku, różne gatunki a nawet rodzaje roślin;
– szczepy o wąskim zakresie gospodarza (ang. narrow host range), zakażające niewielką liczbę odmian danego gatunku lub nawet wyłącznie pojedyncze gatunki roślin.
Niezgodność pomiędzy symbiontami pojawia się najczęściej w przypadku kontaktu szczepu bakterii o wąskim zakresie gospodarza z symbiotycznie wyspecjalizowaną odmianą rośliny.
Rodzaje brodawek
Rodzaj wytwarzanych brodawek zależy jedynie od rośliny. Uwarunkowane jest to prawdopodobnie jej wrażliwością na urydynę.Wyróżnia się dwa rodzaje brodawek:
* niezdeterminowane (nieograniczone):
– tworzone przez rośliny strefy umiarkowanej np. koniczyna, lucerna, groch, w wyniku podziałów kory wewnętrznej korzenia;
– komórki kory zewnętrznej tworzą nić preinfekcyjną umożliwiającą przeprawę nici infekcyjnej [20];
– z powodu stale funkcjonującego merystemu wierzchołkowego mają kształt cylindryczny;
– począwszy od końca dystalnego, brodawki niezdeterminowane składają się z następujących stref:
* merystematyczna;
* inwazyjna, gdzie bakterie uwalniane są do cytoplazmy komórek roślinnych;
* pośrednia (ang. interzone), gdzie gromadzą się amyloplasty a bakterie przekształcają się w bakteroidy;
* wiązania azotu, złożona z komórek roślinnych zawierających bakteroidy i małych komórek gospodarza bez bakteroidów, gdzie ma miejsce asymilacja związanego azotu;
* starzenia się, gdzie komórki roślinne, jak i bakteroidy ulegają degeneracji;
– występujące w nich nici infekcyjne są szerokie i długie;
– zawierają skrobię w komórkach zainfekowanych i niezainfekowanych;
– związany azot transportowany jest na obszar całej rośliny przeważnie w postaci amidów (asparaginy i glutaminy).
* zdeterminowane (ograniczone):
– brodawki zdeterminowane występują na roślinach tropikalnych np. soja, fasola;
– rozwijają się z komórek kory zewnętrznej korzenia, a ich merystem jest aktywny przez krótki okres czasu, są więc okrągłe;
– ich wzrost wynika raczej z rozrostu komórek, niż z ich podziałów;
– nici infekcyjne są wąskie i krótkie;
– skrobia występuje w komórkach niezainfekowanych;
– azot transportowany jest głównie w formie ureidów (alantoiny i kwasu alantoinowego).
Nawiązanie symbiozy
Nawiązanie symbiozy pomiędzy rizobiami a roślinami motylkowymi ma miejsce w warunkach ograniczonej dostępności azotu. Proces ten przebiega na zasadzie wzajemnej wymiany określonej sekwencji związków sygnalnych inicjujących brodawkowanie poprzez aktywację specyficznych genów roślinnych i bakteryjnych.
Bakterie w odpowiedzi na roślinne struktury i mechanizmy obronne, wykształciły szereg przeciwdziałających im strategii. Jednocześnie korzyści jakie przynosi roślinom symbioza z diazotrofami przyczynia się do wytworzenia przez nie mechanizmów ułatwiających infekcję zgodnym, tj. zdolnym do nawiązania efektywnej symbiozy mikrosymbiontom.
Istotną rolę w procesie infekcji odgrywają wydzielane przez roślinę flawonoidy. Wywołują one dodatnią chemotaksję zgodnych, czyli zdolnych do nawiązania efektywnej symbiozy rizobiów. Związki te są także induktorami bakteryjnych genów nod (ang. nodulation) odpowiadających za brodawkowanie (nodulację) roślin. Zdolność do ich aktywacji zależy od gatunku rośliny. U Rhizobium ulegają aktywacji pod wpływem wydzielanych przez rośliny strefy umiarkowanej (np. koniczyna, lucerna, wyka, groch) flawonów i flawononów np. luteoliny, zaś u Bradyrhizobium pod wpływem izoflawonów np. daidzeiny, wydzielanych przez tropikalne rośliny motylkowate (np. soja). Geny nod rizobiów zorganizowane są w operony zlokalizowane na chromosomie lub na jednym z tzw. plazmidów symbiotycznych Sym. Wspólne dla wszystkich rizobiów geny com nod (ang. common nodulation genes) – nodABC, o dużej konserwatywności sekwencji służą do syntezy szkieletu głównego czynników Nod, zaś geny hsn nod (ang. host specific nodulation genes) zależnie od gatunku bakterii występują w różnych kombinacjach i określają specyficzność wobec gospodarza. Ekspresję genów nod indukuje białko regulatorowe NodD (m. cz. ok. 35kDa). Gen nodD jest jedynym genem nod ulegającym konstytutywnej ekspresji, zarówno u bakterii wolno żyjących, jak i będących w symbiozie z roślinami. Przypuszcza się, że dany gatunek rizobiów syntetyzuje określone białko NodD, aktywujące transkrypcję genów nod tylko po związaniu z określonym flawonoidem, co determinuje specyficzność względem gospodarza. Ta specyficzność bakterii wobec różnych aktywatorów może wynikać z różnic w wiązaniu, transporcie i oddziaływaniach z białkami regulatorowymi.
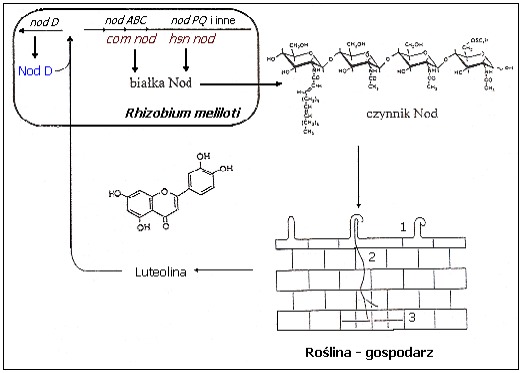
Rys.1. Wymiana cząstek sygnałowych pomiędzy symbiontami i odpowiedzi rośliny na przykładzie oddziaływań Rhizobium meliloti i lucerny. 1-deformacja włośników; 2-tworzenie nici infekcyjnej; 3-podziały komórkowe prowadzące do wytworzenia brodawki
Tzw. czynniki Nod (chitolipooligosacharydy; CLOS ), będące produktami genów nod, to morfogeny, które powodują zwijanie się włośników korzeniowych, tworzenie nici infekcyjnej i powstawanie w korze korzenia nowych merystemów, dając początek brodawkom korzeniowym.
Roślinne bakteriostatyczne izoflawonoidowe fitoaleksyny, udaremniają kontakt mikrosymbiontów z ich komórkami, jednak bakterie zgodne wobec danej rośliny w przeciwieństwie do innych mikroorganizmów patogennych są na nie mniej wrażliwe. Kontakt fitoaleksyn z rizobiami ograniczają przylegające do powierzchni komórek bakteryjnych cykliczne beta-glukany, a wydzielane do otoczenia hamują ich produkcję . W ochronie rizobiów przed działaniem izoflawonoidów biorą udział składniki ich struktur powierzchniowych – lipopolisacharydy (LPS) i egzopolisacharydy (EPS).
Rośliny wydzielają również enzymy, takie jak chitynazy i glukanazy, hydrolizujące ściany mikroorganizmów patogennych, oraz związki niskocząsteczkowe, np. cukry i kwasy organiczne służące bakteriom jako substancje odżywcze. Chitynazy wydzielane przez rośliny hydrolizują syntetyzowane przez bakterie czynniki Nod, czemu zapobiegają chemiczne modyfikacje tych czynników wykluczając je z grupy substratów chitynaz. W wydzielinach korzeni obecne są też oddziałujące z EPS – pektyny, powodujące agregację bakterii w sąsiedztwie włośników korzeniowych. Również mikroorganizmy mogą syntetyzować lektyny, które specyficznie wiążą cukry powierzchni komórek odpowiedniej rośliny. Po połączeniu symbiontów z udziałem lektyn i polisacharydów następuje trwała adhezja bakterii do ścian komórek epidermy korzeni za pomocą syntetyzowanych przez rizobia mikrowłókien celulozowych (R. leguminosarum) lub/i białkowych fimbrii (Bradyrhizobium japonicum).
Czynniki Nod aktywują w roślinie tzw. geny nodulinowe, które w zależności od czasu ich ekspresji dzieli się na wczesne – ENOD (ang. early nodulin genes) – wyrażane przed rozpoczęciem wiązania azotu i późne – LNOD (ang. late nodulin genes) – podczas, lub po wiązaniu azotu. Wczesne noduliny biorą udział w infekcji bakteryjnej (deformacja włośników, tworzenie nici infekcyjnej) oraz morfogenezie brodawek (podziały komórkowe, tworzenie zawiązków brodawek). Późne noduliny to białka niezbędne do funkcjonowania brodawki (np. leghemoglobina), enzymy lub podjednostki enzymów uczestniczących w metabolizmie oraz transporcie azotu i węgla, niektóre białka błony peribakteroidalnej. Część białek LNOD znajduje się poza brodawką i ulega ekspresji nie tylko podczas symbiozy.
Po adhezji rozpoczyna się degradacja roślinnych ścian komórkowych przez związane ze ścianami bakterii pektynazy i celulazy, co umożliwia wniknięcie rizobiów do wnętrza włośników. Bakterie przemieszczają się w kierunku zawiązków brodawek poprzez nici infekcyjne. W ich tworzeniu biorą udział roślinne białka strukturalne i lektyny oraz bakteryjny EPS i łańcuch o-swoisty LPS. W obrębie matrix nici infekcyjnej bakterie namnażają się, a po dotarciu do brodawki uwalniane są do cytoplazmy komórek roślinnych. Rizobia na drodze endocytozy zostają otoczone błonami peribakteroidalnymi pochodzenia roślinnego, stanowiącymi powierzchnię wymiany metabolitów i sygnałów pomiędzy mikrosymbiontem a komórką roślinną. Tak powstają symbiosomy, w obrębie których bakterie przekształcają się w zdolne o wiązania azotu atmosferycznego bakteroidy, czyli zdeformowane komórki bakterii o objętości dzisięcio, a nawet trzydziestokrotnie większej niż rizobia.
Informacja genetyczna bakteroidów w postaci genów nif warunkuje syntezę enzymu nitrogenazy. Tzw. kompleks nitrogenazy złożony z nitrogenazy i reduktazy nitrogenazowej znajduje się w ich cytoplazmie i jest wrażliwy na tlen. Reduktaza nitrogenazowa to kodowany przez gen nich homodimer metaloproteiny Fe o m. cz. ok. 60 kDa. Nitrogenazę, która jest tetramerem metaloproteiny Mo-Fe (o m. cz. ok. 240 kDa kodują geny Nid i nifK. Reduktaza nitrogenazowa dostarcza siły redukcyjnej potrzebnej do wiązania azotu, co wymaga zużycia 16 moli ATP na 1 mol N2. Nitrogenaza przenosi uwolnione przez reduktazę nitrogenazową elektrony na N2, czemu towarzyszy redukcja H+ do H2. U niektórych diazotrofów, wodór powstający obok NH3, tworzy wodę dzięki obecności hydrogenazy, redukując tym samym tlen zagrażający aktywności nitrogenazy. Pozwala to również odzyskać część energii zużytej na wytworzenie wodoru, co przedstawia reakcja:
N2 + 8H+ + 16ATP + 8e– → 2NH3 + H2 + 16ADP + 16Pi
Warunki mikroaerofilne, niezbędne do aktywności nitrogenazy, zapewnia przede wszystkim wiążące tlen białko – leghemoglobina (Lb), będąca hemoproteiną o wysokim powinowactwie do tlenu oraz znacznej homologii i podobieństwie strukturalnym do zwierzęcej hemoglobiny. Grupa prostetyczna leghemoglobiny – protohem, jest syntetyzowana przez bakteroidy, zaś synteza części białkowej odbywa się w komórkach roślinnych. Leghemoglobina obecna jest w cytoplazmie komórek roślinnych, nie występuje natomiast w przestrzeni perybakteroidalnej. Nadaje tkance brodawki zawierającej efektywnie wiążące azot bakteroidy barwę czerwoną. Właściwości leghemoglobiny zapewniają bakteroidom wystarczającą ilość tlenu potrzebną do procesów energetycznych, nie przekraczając takiej, która hamuje wiązanie azotu. Dyfuzję gazów przez ściany brodawki ogranicza dodatkowo wysycenie białkami bogatymi w prolinę ścian nie zakażonych komórek, które otaczają tkanki zasiedlone przez rizobia.
<Br.
Regulacja brodawkowania
Wielorakie mechanizmy regulacyjne wpływają na proces brodawkowania (nodulacji). Istnieje hipoteza, że roślinne hormony gł. kwas abscysynowy (ABA), auksyny, cytokininy, etylen i kwas giberelinowy (GA3) regulują rozwój brodawek. Ich proporcja zmieniana jest przez czynniki Nod. Na kształtowanie się brodawek wpływają też hormony peptydowe, tlenek azotu (NO), aktywne/reaktywne formy tlenu (AOS/ROS), kwas jasmonowy (JA), kwas salicylowy (SA), urydyna, flawonoidy i same czynniki Nod. Różne cząstki sygnalne wymieniane pomiędzy rośliną a infekującymi ją bakteriami regulują inicjację, różnicowanie, funkcjonowanie oraz liczbę brodawek.
Co najmniej dwa szlaki regulują liczbę brodawek:
– miejscowa regulacja infekcji we wrażliwej na nią strefie korzenia;
– autoregulacja poprzez ujemne sprzężenie zwrotne, gdzie merystemy istniejących już brodawek wyzwalają sygnały hamujące powstawanie kolejnych.
Ze względu na znaczną energochłonność procesu wiązania azotu, liczba brodawek musi być ściśle dostosowana do wydajności fotosyntetycznej rośliny. Autoregulacja sprawowana jest przez czynnik pochodzący prawdopodobnie z liści, poruszający się w kierunku korzeni. Może on być łącznikiem pomiędzy inicjacją brodawkowania a aktywnością fotosyntetyczną gospodarza.
Kwas abscysynowy (ABA) jest inhibitorem rozwoju brodawek, hamującym stymulowane cytokininami podziały komórek kory korzenia. Na nodulację wpływa proporcja ABA:cytokoniny, istnieje więc interakcja pomiędzy „sygnalingiem” tych hormonów. Pewien model zakłada, że zakażenie indukuje początkowy spadek ilości ABA w ksylemie, po czym oba hormony translokowane są do liści gdzie następuje synteza ABA powracającego poprzez floem do korzeni i hamującego tworzenie kolejnych brodawek. Wzrost ilości ABA w brodawkach może indukować gromadzenie się w nich cukrów, zatem drugą jego funkcją w procesie nodulacji jest przydzielanie (alokacja) brodawkom (organom „sink”) fotoasymilatów – źródła energii potrzebnej do wzrostu, rozwoju, oddychania i wiązania azotu przez rizobia. ABA powoduje wzrost akumulacji mRNA lipooksygenazy (LOX), której aktywność w wierzchołkach rozwijających się, ale nie w dojrzałych brodawkach sugeruje, że uczestniczy w ich wzroście i rozwoju. W regionie tym podwyższona jest też ilość ABA. Poza dwojakim wpływem ABA na nodulację tj. negatywnej regulacji ich ilości a pozytywnej wzrostu i rozwoju pojedynczych brodawek, istnieje trzecia jego funkcja. Początkowo wysoki poziom ABA, związany z regulacją ich wzrostu i liczby, osiąga na etapie wiązania azotu plato, po czym znów wzrasta. Wiąże się to z udziałem ABA w starzeniu się brodawek.
Auksyny syntetyzowane głównie w pędach są aktywnie transportowane do korzeni. Podczas nodulacji uczestniczą w podziałach i różnicowaniu się komórek oraz w tworzeniu merystemów. Indukują ekspresję genów cyklu komórkowego potrzebnych do aktywacji podziałów komórkowych. Dlatego podwyższony ich poziom poprzedza tworzenie brodawek i utrzymuje się we wczesnych etapach ich rozwoju, a obniża się w dojrzałych brodawkach. W wielu gatunkach roślin poziom auksyn w brodawkach przewyższa ich ilość w korzeniach. Stosunek auksyn do cytokinin w korzeniach odpowiada za inicjację podziałów komórek kory i powstawanie brodawek oraz regulację ich liczby. Przypuszcza się, że rizobia mogą manipulować poziomem auksyn u roślin hamując ich transport, co zmniejsza ich ilość względem cytokinin i promuje brodawkowanie. Poziom auksyn może być też regulowany poprzez kontrolę ilości ich transporterów. Syntetyczne inhibitory transportu auksyn indukują wytwarzanie pseudobrodawek oraz ekspresję genów nodulin (ENOD 12,40,2). Składniki roślinne tj. etylen, cytokininy, flawonoidy, mogą hamować transport auksyn oraz regulować aktywność rozkładających je enzymów np. peroksydazy, oksydazy kwasu indolilo-3-octowego. Podwyższona aktywność peroksydazy w dojrzałych brodawkach P. vulgaris ma prawdopodobnie ograniczyć w nich wzrost poziomu auksyn. Niektóre flawonoidy hamują rozkład auksyn przez w/w enzymy a inne go stymulują. Wskazuje to na lokalną regulację ich poziomu.
Cytokininy stymulują inicjowane przez rizobia podziały komórek kory korzenia. Fitohormony te, podobnie jak bakteryjne czynniki Nod, indukują też depozycję amyloplastów i ekspresję niektórych genów, np. enod40. Wskazuje to na istnienie w korze wewnętrznej elementów wspólnych dla ich szlaków sygnałowych. Czynniki Nod wywołują prawdopodobnie zmiany w syntezie cytokinin, ich obrocie lub wrażliwości na nie komórek korzenia. Poziom cytokinin w korzeniu zmieniany jest też przez rizobia i jest niższy w porównaniu z brodawkami. Jest też wyższy w młodych (aktywnych mitotycznie) i rozwijających się brodawkach, szczególnie w ich merystemach a spada wraz z osiągnięciem przez nie dojrzałości. Rola cytokinin w nodulacji obejmuje aktywację cyklu komórkowego i związanych z nim genów. Mogą też brać udział w aktywacji części genów ENOD. Zbadano, że część genów nodulin lucerny regulowanych przez cytokininy, indukowanych jest też przez auksyny, co sugeruje częściowe nakładanie się tych szlaków regulacyjnych. Przypuszczalną rolą cytokinin jest też skierowywanie węglowodanów do rozwijających się brodawek. Sądzi się, że nie same cytokininy lecz stosunek cytokininy:auksyny pełni istotną rolę w nodulacji.
Poziom etylenu wzrasta lokalnie w korzeniach lucerny, wyki i soi zakażonych rizobiami. Wiąże się to z początkiem odpowiedzi obronnej rośliny. Zastosowanie inhibitorów syntezy lub percepcji etylenu (np. Ag2+) powoduje wzrost ilości brodawek. Zakłada się, że etylen indukuje roślinne chitynazy niszczące czynniki Nod. W przypadku grochu (pea) etylen blokuje raczej wejście rizobiów do kory korzenia a nie samą infekcję. Negatywna regulacja etapu infekcji przez etylen ma miejsce u M. truncatula. Etylen nie jest więc zaangażowany w systemową/układową autoregulację nodulacji. Bierze raczej udział w regulacji częstości infekcji działając miejscowo w podatnych na nią strefach korzenia. Rola etylenu w nodulacji może zależeć od infekujących roślinę rizobiów. W grochu poprzez oddziaływanie na cytoszkielet, etylen może być zaangażowany w tworzenie nici preinfekcyjnej i infekcyjnej oraz prawdopodobnie w określanie położenia zawiązków brodawek. Wykazano, że etylen zmienia fenotyp brodawek Sesbania rostrata, która w przypadku jego braku tworzy brodawki niezdeterminowane, a w obecności – zdeterminowane. Sugeruje to udział etylenu w różnicowaniu merystemu. Rhizobitoksyna produkowana przez Bradyrhizobium elkami działa jako inhibitor syntezy etylenu i wzmacnia nodulację siratro (Macroptilium atropurpureum).
Gibereliny w brodawkach wielu roślin strączkowych występują w większych ilościach niż w sąsiednich tkankach korzenia. Dodanie kwasu giberelinowego (GA3) do ekstraktu brodawek L. luteus stymuluje produkcję kwasu indolilo-3-octowego (IAA – auksyna), sugeruje się istnienie pomiędzy nimi sygnalingu. GA3 może zwiększać bioprodukcję lub zmniejszać metabolizm IAA. Zatem nie same gibereliny, co stosunek gibereliny:IAA istotny jest dla nodulacji. Różne szczepy rizobiów zdolne są do syntezy giberelin, mogą więc regulować ich poziom w brodawkach. Istnieje hipoteza, że poza szczepem bakteryjnym także azotan, ABA, a nawet gatunek rośliny wpływa na stężenie giberelin w brodawkach. Pozytywną regulację podziałów komórek pericyklu, koniecznych do wytworzenia brodawki, sprawowaną przez gibereliny hamuje azotan. Wzrost stężenia giberelin może nie być konieczny do tworzenia brodawek np. przez P. vulgaris. Możliwe więc, że wzrost ilości giberelin w brodawkach jest jedynie konsekwencją wysokich poziomów IAA. Gibereliny mogą też działać jako sygnały do hydrolizy skrobi w brodawkach w celu dostarczenia rizobiom substratów oddechowych. Hormony te promują produkcję alfa-amylazy. Istnieje związek pomiędzy giberelinami a alfa-amylazą w reakcjach hydrolizy u różnych gatunków grzybów. Możliwe więc, że bakterie odpowiedzialne są za regulację poziomów giberelin w brodawkach, mających znaczenie w dostarczaniu im substancji odżywczych. Podwyższone poziomy giberelin w brodawkach skorelowane są ze wzrostem liczby i długości międzywęźli oraz ze wzrostem długości ogonków liściowych P. lunatus i Dolichos chinensis (wspięga/fasolnik). Gibereliny mogą zatem przynosić korzyści obu symbiontom, zwiększając rozmiary rośliny co podnosi jej możliwości fotosyntetyczne. Daje to więcej fotoasymilatów zarówno roślinie, jak i brodawkom do ich wzrostu i funkcjonowania.
Peptydy sygnalne uczestniczące w regulacji brodawkowania
Poza klasycznymi hormonami roślinnymi, również niektóre peptydy uważane są za potencjalne regulatory nodulacji. Rośnie liczba odkrywanych kinaz receptorów aktywowanych przez ligandy peptydowe, uczestniczących w rozwoju i nodulacji roślin. Jest to np. kinaza receptora odpowiedzialna za wczesną percepcję/transdukcję sygnału czynników Nod – „NORK” (ang. nodulation receptor kinase) oraz za autoregulację nodulacji – „NARK” (ang. nodule autoregulation receptor kinase).
Jednym z takich peptydów jest wczesna nodulina ENOD40, określana mianem molekularnego markera infekcji ulegająca ekspresji podczas intensywnych podziałów merystematycznych rozpoczynających proces tworzenia brodawki. Sekwencje kodowane przez ENOD40 to poliadenylowe transkrypty złożone z 700 par zasad, nie zawierające długiej ramki odczytu (ORF). Dlatego uważa się, że nie białko, lecz mRNA (tzw. ryboregulator czy też regulacyjne RNAs) może być aktywnym produktem regulującym wczesne etapy nodulacji. Odkryto, że do biologicznej aktywności, czyli indukowania podziałów komórek kory korzenia, konieczna jest translacja dwóch małych ORFów ENOD40, których produkty mają za zadanie stabilizować biologiczną aktywność jego mRNA. Prawdopodobnie oba peptydy i mRNA działają jako rybonukleoproteina.
ENOD40 wydaje się regulować cykl komórkowy, ponieważ jego nadekspresja i „mikrotargeting” indukuje podziały komórek kory korzenia lucerny w nieobecności rhizobiów. Natomiast w obecności tych bakterii, ENOD40 przyspiesza nodulację. Nodulina ta może też brać udział w przydzielaniu (ang. partitioning) sacharozy lub w jej rozładowywaniu z floemu w obrębie brodawki i/lub całej rośliny, ponieważ syntetyczne ENOD40 przyłączają się do noduliny100, którą jest syntaza sacharozy (SS). Ta rola EDON40 może wiązać się z promowaniem podziałów komórek kory korzenia, bo będący w początkowym stadium rozwoju merystem jest silnym organem „sink”, tzn. ma duże zapotrzebowanie na węglowodany. Ekspresja ENOD40 w tkance naczyniowej korzeni i w dojrzałych brodawkach potwierdza jego udział w rozładowywaniu sacharozy z floemu.
Ekspresja ENOD40 indukowana jest przez sygnał molekularny mogący inicjować podziały komórek kory korzenia, np. czynniki Nod, cytokininy, inhibitory transportu auksyn. ENOD40 indukowany jest też w zawiązkach brodawek przez szczepy rizobiów, które inicjują podziały komórkowe, ale nie infekują rośliny. Wskazuje to, że ENOD40 jest zaangażowany raczej w morfogenezę brodawki niż w proces infekcji. Nodulina ta ulega ekspresji także podczas tworzenia korzeni bocznych, galasów wywoływanych przez nicienie i interakcji mikoryzowych. Ekspresja ENOD40 w tkance naczyniowej łodygi, korzeniach bocznych i kwiatach roślin strączkowych, ale i niestrączkowych, jak ryż czy tytoń, wskazuje, że nie jest on związany jedynie z nodulacją.
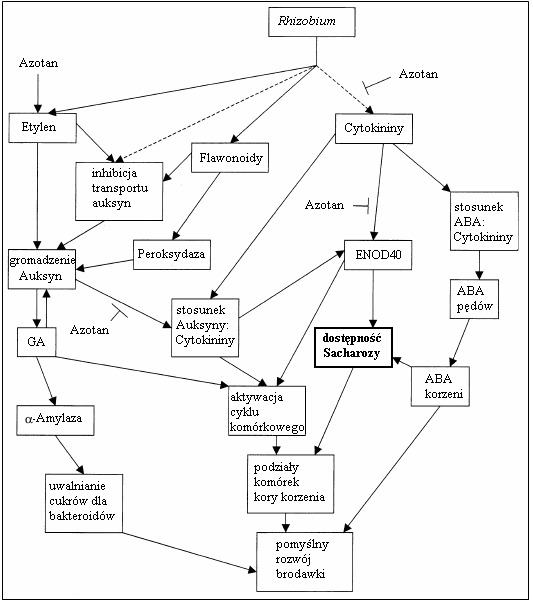
Rys.2. Model interakcji hormonów i innych cząstek sygnalnych uczestniczących w regulacji brodawkowania [wg. 30, zmienione]
Marta Muszyńska
Literatura:
1. Paul E.A., Clark F.E. (2000) ”Mikrobiologia i biochemia gleb” Wydawnictwo UMCS, Lublin
2. Jakubowska A., Kowalczyk K. (1998) „Biochemiczne i molekularne podstawy symbiotycznych oddziaływań bakterii i roślin” Postępy biochemii 44(1):73-82
3. Schlegel H. G. (2003) „Mikrobiologia ogólna” PWN Warszawa
4. Van Rhijn P., Vanderleyden J. (1995) „The Rhizobium – Plant Symbiosis” Microbiol. Reviews 59/1:124-142
5. Wielbo J., Skorupska A. (2003) „Ewolucja układu symbiotycznego Rhizobium – rośliny motylkowate” Post. Mikrobiol. 42/3:263-283
6. Schultze M., Kondorosi A. (1998) „Regulation of symbiotic root nodule development” Annu. Rev. Genet. 32:33-57
7. Stougaard J. (2000) „Regulators and Regulation of Legume Root Nodule Development” Plant Physiol. 124:531-540
8. Wielbo J., Skorupska A. (2003) „Strategie symbiotycznych Rizobiów w pokonywaniu reakcji obronnych roślin motylkowatych” Postępy Biologii Komórki 30 /3:433-446
9. Takeda N., Okamoto S., Hayashi M., Murooka Y. (2005) „ Expression of LjENOD40 Genes in Response to Symbiotic and Non-symbiotic Signals: LjENOD40-1 and LjENOD40-2 are Differentially Regulated in Lotus japonicus” Plant Cell Physiol 46(8):1291-1298
10. Verghese S., Misra A.K. (2002) „Frankia – actinirhizal symbiosis with special reference to host – microsymbiont relationship” Current Science 83/4:562-566
11. Shimoda Y., Nagata M., Suzuki A., Abe M., Sato S., Kato T., Tabata S., Higashi S., Uchiumi T. (2005) „Symbiotic Rhizobium and Nitric Oxide Induce Gene Expression of Non-symbiotic Hemoglobin in Lotus japonicus” Plant Cell Physiol 46(1):99-107
12. Porta H., Rueda-Benitez P., Campos F., Colmenaro-Flores J.M., Colorado J.M., Carmona M.J., Covarrubias A.A., Rocha-Sosa M. (1999) „Analysis of lipoxygenase mRNA accumulation in the common bean (Phaseolus vulgaris L.) during development and under srtess conditions.” Plant Cell Physiol 40:850-858
13. Van Ghelue M., Ribeiro A., Solheim B., Akkermans A.D.L., Bisseling T., Pawlowski K. (1996) „Sucrose synthase and enolase expression in actinorhizal nodules of Alnus glutinosa: comparison with legume nodules” Mol Gen Genet 50:437-446
14. Pasternak O., Sikorski M.M. (2002) „Cytokininy w mechanizmach obronnych roślin” Biotechnologia 3(58):153-164
15. Pieter E., Yan F., Schubert S. (2004) „Amino acid export from infected cells of Vicia faba root nodules: Evidence for an apoplastic step in the infected zone” Physiologia Plantarum 122:107-114
16. Janczarek M., Mazur A., Wielbo J., Król J., Skorupska A. (1999) „Egzopolisacharydy Rizobiowe: struktura, biosynteza i funkcja w symbiozie” Post. Mikrobiol. 38/3:217-244
17. Heidstra R., Yang Y.C., Yalcin Y., Peck S., Emons A.M., van Kammen T., Bisseling T. (1997) „Ethylene provides positional information on cortical cell division but is not involved in Nod factor-induced root hair tip growth in Rhizobium legume interaction.” Development 124:1781-1787
18. Guinel F.C., Geil R.D. (2002) „A model for the development of the rhizobial and arbuscular mycorrhizal symbioses in legumes and its use to understand the roles of ethylene in the establishment in these two symbioses.” Can J Bot 80:695-720
19. Gubler F., Kalla R., Roberts J.K., Jacobsen J.V. (1995) „Gibberellin-regulated expression of a myb gene in barley aleurone cells: evidence for Myb transactions of a high-pl -amylase gene promoter.” Plant Cell 7:1879-1891
20. Gordon A.J., James C.L. (1997) „Enzymes of carbohydrate and amino acid metabolism in developing and mature nodules of white clover” Journal of Experimental Botany 48/309:895-903
21. Gálvez L., González E.M., Aresse-Igor C. (2005) „Evidence for carbon flux shortage and strong carbon/nitrogen interactions in pea nodules at early stage of water stress” Journal of Experimental Botany 56/419:2551-2561
22. Ferguson B.J., Mathesius U. (2003) „Signaling Interactions During Nodule Development” J Plant Growth Regul 22:47-72
23. Fedorova E.E., Zhiznevskaya G.Y., Kalibemaya Z.V., Artemenko E.N., Izmailov S.F., Gus,kov A.V. (2000) „IAA metabolism during development of symbiosis between Phaseolus vulgaris and Rhizobium phaseoli.” Russ J Plant Physiol 47:203-206
24. Engelhard M. (2004) „Trehalose and the nitrogen fixing nodule symbiosis of legumes: studies on rhizobia deficient in the trehalose-6-phosphate synthase gene „otsA” Inauguraldissertation zur Erlangung der Würde eines Doktors der Philosophie vorgelegt der Philosophisch-Naturwissenschaftlichen Fakultät der Universität Basel, Deutschland
25. Dobert R.C., Rood S.B., Zanewich K., Blevins D.G. (1992) „Gibberellins and the legume-Rhizobium symbiosis III. Quantification of gibberellins from stems and nodules of Lima Bean and cowpea.” Plant Physiol 100:1994-2001
26. Day D.A., Copeland L. (1991) „Carbon metabolism and compartmentation in nitrogen-fixing legume nodules” Plant Physiol. Biochem. 29(2):185-201
27. Crespi M., Gálvez S. (2000) „Molecular Mechanisms in Root Nodule Development” J Plant Growth Regul 19:155-166
28. Caba J.M., Recalde L., Ligero F. (1998) „Nitrate-induced ethylene biosynthesis and the control of nodulation in alfalfa.” Plant CellEnv 21:87-93
29. Ferguson B.J., Reid J.B. (2005) „Cochleata: Getting to the Root of Legume Nodules” Plant Cell Physiol 46(9):1583-1589
30. Murakami-Mizukami Y., Yamamoto Y., Yamaki S. (1991) „Analysis of indole acetic acid and abscisic acid contents in nodule of soybean plants bearing VA Mycorrhizas.”Soil Sci Plant Nutr 37:291-298

