Każda komórka oddzielona jest od środowiska zewnętrznego płynną, mozaikową strukturą (ang. fluid mosaic structure) zbudowaną z białek i tłuszczy – błoną komórkową. Najpowszechniej występują w niej fosfolipidy, czyli cząsteczki o charakterze amfipatycznym. Jeden ich koniec jest hydrofilowy (dobrze rozpuszcza się w wodzie), natomiast drugi ma charakter hydrofobowy (dobrze rozpuszcza się w tłuszczach). Hydrofilowe fosfatydowe głowy skierowane są w stronę zewnętrznego, wodnego środowiska. Niepolarne bieguny kwasów tłuszczowych tworzą natomiast hydrofobowe wnętrze. Wpływa to w znaczący sposób na właściwości błony oraz na charakter transportowanych przez nią substancji.

Rys. 1. Budowa fosfolipidu (A) i ich zachowanie się w środowisku wodnym (B)
Dyfuzja prosta
Cząsteczki niepolarne, tzn. rozpuszczalne w tłuszczach, przenikają przez warstwy fosfolipidowe na zasadzie prostej dyfuzji. Są to np. cząsteczki tlenu, dwutlenku węgla, kwasy tłuszczowe, hormony steroidowe i rozpuszczalniki organiczne (alkohole, etery…). Średnica tych związków nie ma znaczenia, a dyfuzja odbywa się w obu kierunkach i zgodnie z gradientem stężeń (tzn. zawsze od strony większego stężenia do mniejszego). Prowadzi to do wyrównania zawartości substancji po obu stronach półprzepuszczalnej błony. Każdy ruch wiąże się ze zużyciem energii. W przypadku dyfuzji prostej jest to energia kinetyczna powstająca dzięki przypadkowym kolizjom cząsteczek, czyli ruchom Browna.
Dyfuzja ułatwiona
Większość transportowanych substancji jest rozpuszczalna w wodzie, tzn. cechuje się budową polarną i z tego powodu nie może przekroczyć lipidowego rdzenia błony. Ich transport uzależniony jest od obecności specjalnych białek zatopionych w dwuwarstwie. Za ich pomocą wybrane cząsteczki mogą dyfundować przez błonę zgodnie z gradientem stężeń. Jest to tzw. dyfuzja ułatwiona (ang. facilitated diffusion).
Tak zwane kanały błonowe różnią się od siebie budową i funkcją. Można jednak wyróżnić kilka łączących je cech. Większość z nich zbudowana jest z kilku (4-6) homologicznych podjednostek lub inaczej domen. Przez ich środek przebiega por wypełniony cząsteczkami wody. Wnętrze poru wyścielają α helisy oraz odcinki o antyrównoległej β strukturze. Kanały te mogą działać wybiórczo, a ich średnica niczym sito reguluje wielkość przepuszczanych związków. O selektywności kanałów decydują również boczne łańcuchy wystające z innych elementów strukturalnych.
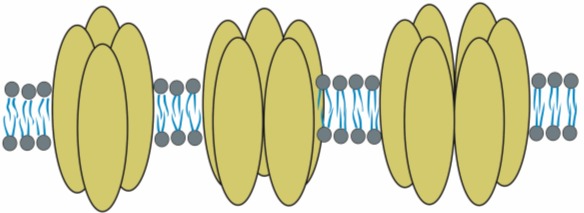
Rys. 2. Kanały błonowe składają się z 4, 5 lub 6 podjednostek. Wraz z liczbą domen wzrasta średnica kanału. Środkowa oś symetrii wyznacza por, czyli bramkowaną i wypełnioną wodą drogę dla jonów
Kanały jonowe otwierane są na zasadzie „wszystko albo nic”, a intensywność bodźca otwierającego wpływa jedynie na ilość zdolnych do transportu porów. Ze względu na rodzaj czynnika aktywującego możemy je podzielić na trzy podstawowe grupy:
• kanały zależne od napięcia – regulowane przez potencjał błonowy (depolaryzację lub hyperpolaryzację)
Posiadają one tzw. czujnik potencjału, czyli naładowany elektrycznie fragment reagujący na zmiany pola elektrycznego w błonie. Jego ruch powoduje zmianę konformacji bramki aktywacyjnej i otwarcie poru. Przez pewien czas po zamknięciu, kanał pozostaje niewrażliwy na bodźce. Tzw. filtr selektywności odpycha niektóre jony i dzięki temu warunkuje specyficzność działania, np. kanał receptora acetylocholinowego jest selektywny dla kationów, ponieważ jego por zawiera pierścienie naładowane ujemnie.
Zależne od napięcia kanały sodowe i potasowe są odpowiedzialne za zmiany w przepuszczalności błon wielu komórek pobudliwego typu.
• kanały zależne od ligandu – kanały aktywowane chemicznie
Również i ten typ kanałów jest selektywny względem różnych rodzajów jonów. Otwierają się one, gdy cząsteczka ligandu zostaje przyłączona do specyficznego miejsca wiążącego. Jest to zjawisko odwracalne i po pewnych czasie kanał ulega ponownemu zamknięciu. Podczas przedłużonych obecności wysokich stężeń ligandu, kanały tracą na pewien czas swoją wrażliwość. Do najlepiej poznanych przedstawicieli tej grupy należy kationowo- selektywny receptor acetylocholiny (nAChR).
• kanały aktywowane napięciem mechanicznym – mechanoreceptory
Stanowią najlepiej poznaną grupę kanałów jonowych. Występują w komórkach dokonujących zamiany bodźców mechanicznych na elektryczne i otwierane są w wyniku działania sił odkształcających błonę.
Niektóre rodziny kanałów błonowych pozwalają na transport większych związków chemicznych, np. aminokwasów lub cukrów. Istnieją również skomplikowane struktury przewodzące nowo zsyntetyzowane łańcuchy polipeptydowe. Jest to zjawisko kluczowe dla sekrecji białek i możliwe dzięki rozwiniętej konformacji łańcuchów, które dopiero po przekroczeniu dwuwarstwy zwijają się w odpowiednią strukturę wyższego rzędu.
Osmoza
Specyficznym typem prostej dyfuzji jest osmoza, czyli transport cząsteczek rozpuszczalnika z roztworu o mniejszym stężeniu substancji, do roztworu o stężeniu większym. O wymianie wody pomiędzy komórką a środowiskiem zewnętrznym decyduje tzw. siła ssąca. Gdy równa się ona zeru oznacza to, że ustalona została równowaga potencjału osmotycznego i komórka osiągnęła maksymalny turgor.
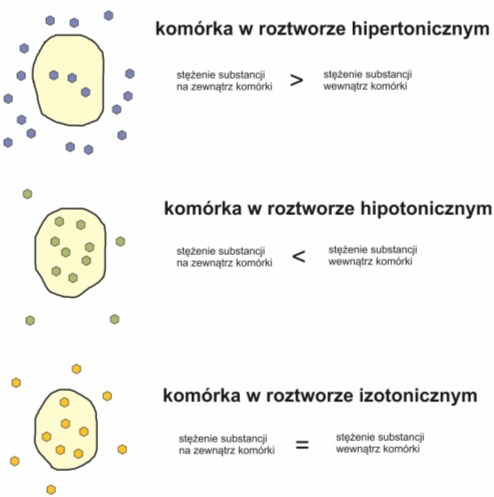
Rys. 3. Typy roztworów. Komórki zanurzone w płynie hipotonicznym ulegają powiększeniu lub nawet rozsadzeniu. W kontakcie z roztworem hipertonicznym, komórki roślinne podlegają odwracalnemu zjawisku plazmolizy, tzn. odrywaniu się protoplastu od ściany komórkowej
Zjawiska osmotyczne odgrywają ważną rolę w życiu roślin. Regulują zawartość wody i turgor, nadają rosnącym tkankom siłę niezbędną do przebicia się przez glebę, warunkują również odporność na zimno i suszę. Wyjątkiem jest tzw. susza fizjologiczna spowodowana zbyt niska temperaturą lub niewłaściwym zasoleniem gleby.
Autor: Anna Kurcek
Literatura:
• Władysław Z. Traczyk „Fizjologia człowieka w zarysie” Wydanie IV poprawione i uzupełnione, Państwowy Zakład Wydawnictw Lekarskich Warszawa 1989;
• Lubert Stryer „Biochemia”, Wydawnictwo Naukowe PWN, Warszawa 2003;
• Ewa Pyłka-Gutowska “Biologia vademecum maturzysty”, Wydawnictwo “Oświata” Warszawa 2002;
• „Kanały jonowe” Katedra i Zakład Biofizyki 1998; http://www.biofiz.am.wroc.pl/.

