Autor: Beata Jantoń, Bordeaux Sciences Agro, France
Tlenek tytanu (IV) (TiO2) to biały proszek, który w środowisku naturalnym można spotkać w trzech odmianach polimorficznych: jako minerały brukitu, rutylu i anatazu [1]. Anataz jest odmianą metastabilną, powstającą w niższych temperaturach niż rutyl [1]. Anataz tworzy kruche, tetragonalne kryształy o barwie od czerwonobrunatnej do czarnej. Pierwsze artykuły dotyczące wykorzystania TiO2 pojawiały się już w latach 60. ubiegłego wieku. Natomiast w ciągu kilku ostatnich lat gwałtownie wzrosło zainteresowanie oraz liczba publikacji na jego temat. Popularność ta może wynikać z ogromnych możliwości i zastosowań TiO2, na które składają się m.in. jego właściwości fotokatalityczne.
Historia badań nad TiO2 rozpoczęła się, gdy Fujishima i wsp. (2000) na Uniwersytecie w Tokio rozpoczęli studia nad tlenkowymi półprzewodnikami [2]. Wykazali oni, że woda w obecności TiO2 ulegała rozkładowi do tlenu i wodoru, bez użycia zewnętrznego napięcia, przy napromieniowaniu próbek światłem z zakresu UV-VIS [2]. Reakcję tą można wytłumaczyć przy pomocy równań opisanych przez autorów pracy:

Cyjanobakterie (sinice) są to gram-ujemne organizmy prokariotyczne zdolne do fotosyntezy. Ich środowiskiem naturalnym jest głównie woda, ale występują także we wszystkich ekosystemach, na wszystkich kontynentach. W sprzyjających warunkach środowiska, zwłaszcza w zeutrofizowanych zbiornikach wodnych, sinice gwałtownie rosną i masowo się rozwijają, jak opisali w pracy Lechowski i Białczyk (2001) [3]. Zakwity sinic pojawiają się najczęściej, gdy temperatura wody wynosi od 15ºC do 30ºC, pH od 6 do 9, współczynnik jonów N:P jest większy, bądź równy 5 oraz prędkość wiatru wynosi poniżej 4m·s-1. Niektóre gatunki sinic produkują związki o charakterze neurotoksycznym. Jedną z neurotoksyn pochodzenia sinicowego jest anatoksyna-a [4].
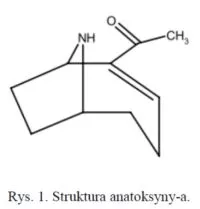
Anatoksyna-a (ANTX-a) to niesymetryczny, bicykliczny alkaloid o masie cząsteczkowej równej 165,23 Da (rys. 1). Zdolność do syntezy ANTX-a wykazują różne szczepy słodkowodnych cyjanobakterii m.in. Anabaena flos-aquae, A. circinalis, Oscillatoria, Aphanizomenon flos-aquae, Cylindrospermum, Planktothrix [5] oraz Artrhospira fusiformis [6]. Badania na jej temat są prowadzone głównie w Niemczech, Korei Południowej, Japonii, Finlandii i Irlandii [7-11]. Dawka śmiertelna dla tej toksyny po której śmierć następowała u 50% badanych zwierząt (LD50) została oszacowana na 200 μg·kg-1 (podanie dootrzewnie u myszy) [12]. Anatoksyna-a jest agonistą nikotynowych i muskarynowych receptorów acetylocholiny, gdzie zaburza działanie naturalnego neuroprzekaźnika. Mechanizm polega na tym, że toksyna wiąże się trwale z receptorem acetylocholinowym i nie jest rozkładana przez esterazę acetylocholinową. Skutkuje to stałą depolaryzacją synapsy nerwowo-mięśniowej powodującą stały skurcz mięśnia.
W związku z coraz większym stopniem eutrofizacji wody na świecie, która przyczynia się do powstawania zakwitów fitoplanktonu, w tym sinic produkujących m.in. anatoksynę-a, rozpoczęto studia nad skutecznymi sposobami degradacji tej neurotoksyny. Wykazano dotychczas, że przyspieszona degradacja ANTX-a zachodzi pod wpływem wysokiej temperatury, alkalicznego pH oraz promieniowania UV-B, przy czym w temperaturze około 20ºC jest to stosunkowo stabilna cząsteczka. Celem tej pracy było zbadanie wpływu tlenku tytanu (IV) w różnych stężeniach na stabilność cząsteczki anatoksyny-a z wykorzystaniem promieniowania w zakresie UV-B lub w zakresie widzialnym.
Otrzymano następujące wyniki z analizy z HPLC próbek naświetlanych zakresem promieniowania widzialnego:

Oraz następujące wyniki z analizy z HPLC próbek naświetlanych zakresem promieniowania UV-B: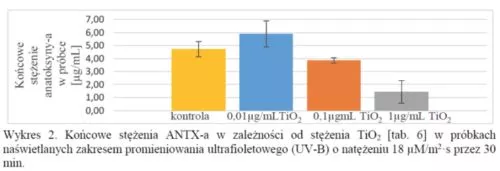
Przeprowadzono również analizę kontrolną przez trzymanie próbek w ciemności: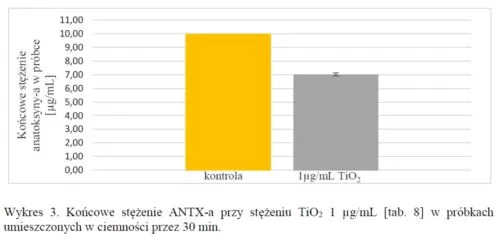
Z uzyskanych wyników można wywnioskować, że światło odgrywa rolę w rozkładzie anatoksyny-a. W próbkach TiO2, które znajdowały się w ciemności doszło do rozkładu toksyny, lecz nie wiadomo czym było to spowodowane. Należałoby wykonać większą ilość powtórzeń takich próbek lub wydłużyć czas ich inkubowania w ciemności.
Wyniki pokazują również, że zastosowanie promieniowania w zakresie widzialnego (VIS) nie działa tak dobrze jak zastosowanie promieniowania w zakresie UV-B. Dlatego też przeprowadzono więcej powtórzeń próbek napromieniowanych zakresem UV-B.
Niektóre końcowe stężenia anatoksyny-a w próbkach napromieniowanych zakresem widzialnym były wyższe od stężeń kontrolnych. Może to wynikać z parowania tych próbek z powodu ciepła produkowanego przez żarówkę, pomimo chłodzenia ich wiatrakami. Przypuszczalnie można wyeliminować ten problem poprzez zastosowanie żarówek LED lub poprzez inną metodę chłodzenia niż przy użyciu wiatraków.
W trzech próbkach z pięciu z ANTX-a i tlenkiem tytanu (IV), o stężeniu 1 μg/mL naświetlanych przez 30 min zakresem UV-B o natężeniu 18 μM/m2·s, ANTX-a została całkowicie rozłożona, z czego wynika, że tlenek tytanu (IV) wspomaga i przyspiesza rozkład ANTX-a pochodzenia sinicowego w zakresie promieniowania UV-B.
W ostatnich latach obserwowany jest duży wzrost liczby oraz intensywności zakwitów sinic w słodkowodnych zbiornikach wodnych [17]. Masowe zakwity sinic mogą stanowić szczególny problem, gdy dominują w nich gatunki wytwarzające toksyny. Czterdzieści spośród blisko 3500 opisanych gatunków sinic ma zdolność do biosyntezy toksycznych dla ludzi, zwierząt i roślin metabolitów wtórnych. Jednym z nich jest ANTX-a. Obecnie badania na jej temat prowadzone są w nielicznych krajach takich jak Niemcy, Korea Południowa, Japonia, Finlandia, czy Irlandia [6-10]. Aby ograniczyć tworzenie zakwitów fitoplanktonu między innymi: edukuje się rolników, aby umiarkowali stosowanie nawozów sztucznych, buduje się oczyszczalnie wody na rzekach w których rozpuszczone są znaczne ilości nutrientów i materii organicznej oraz napowietrza się i zapewnia cyrkulację wody w zbiornikach, a także używa się ryb, które potrafią filtrować wodę [18, 19]. Niestety wszystkie wymienione wcześniej procesy są kosztowne, dlatego wciąż poszukuje się nowych rozwiązań do eliminacji sinic i wytwarzanych przez nie toksyn. Próbuje się znaleźć metody, których celem byłoby rozkładanie m.in. ANTX-a.
W badaniach Kamińskiego i wsp. (2013) studiowano stabilność ANTX-a pod wpływem czynników abiotycznych, takich jak temperatura, natężenie światła, pH i promieniowanie UV [20]. Wykazano, że ANTX-a jest najwydajniej rozkładana w zakresie promieniowania UV-B w alkalicznym pH środowiska.
W tej pracy starano się wykazać wpływ TiO2 w zakresie promieniowania UV-B na stężenie ANTX-a. Fakt, że anatoksyna-a jest rozkładana przez tlenek tytanu (IV) może być, po przeprowadzeniu dalszych eksperymentów w tym w skali półtechnologicznej, wykorzystany w różnego rodzaju instytucjach, takich jak np. firmy wodociągowe , czy stacje uzdatniania wody w celu jej oczyszczania. Zastosowanie 30 minutowego napromieniowania próbek zakresem UV-B dawało, przy stężeniu TiO2 równym 1 μg/mL bardzo dobre rezultaty i w części próbek pozwoliło na degradację toksyny do poziomu poniżej progu detekcji na HPLC (10 ng/mL). Ze względu na potencjalne wykorzystywanie tej metody na skalę przemysłową dłuższy czas napromieniowania byłby nieopłacalny ekonomicznie.
Badania dotyczące tego tematu należałoby rozszerzyć. Stosując m. in. wyższe stężenia tlenku tytanu (IV), czy większe natężenia promieniowania UV-B.
Literatura:
[1] U. Diebold, The surface science of titanium dioxide, Surface Science Reports 48 (2003) 53-229.
[2] A. Fujishima, T. N. Rao, D. A. Tryk, Titanium dioxide photocatalysis, Journal of Photochemistry and Photobiology C: Photochemistry Reviews 1 (2000) 1–21.
[3] Z. Lechowski, J. Białczyk , Rola i znaczenie polisacharydów sinic w przyrodzie i biotechnologii, Wiad. Bot. 45 (2001) 35-51.
[4] A. Błaszczyk, H. Mazur-Marzec, BMAA and other cyanobacterial neurotoxins, The journal of Polish Hyperbaric Medicine and Technology Society 4 (2006) 4-15.
[5] W. W, Carmichael., Toksyny cyjanobakterii, Świat Nauki, 3 (1994) 32-39.
[6] L. Krienitz, A. Ballot, K. Kokut, C. Wiegand, S. Putz, J. S. Metcalf, G. A. Codd, S. Pflugmacher, Contribution of hot spring cyanobacteria to the mysterious deaths of Lesser Flamingos at Lake Bogoria, Kenya., Microbiology Ecology 43 (2003) 141-148.
[7] C. Bumke-Vogt, W. Mailahn, I. Chorus, Anatoxin-a and neurotoxic cyanobacteria in German lakes and reservoirs, Environmental toxicology 14 (1999) 117-125.
[8] H. Park, B. Kim, E. Kim, T. Okino, Hepatotoxic microcystins and neurotoxic anatoxins in cyanobacteria blooms from Korean lakes, Environmental Toxicology and Water Quality 13 (1998) 225-234.
[9] K. Harada, T. Mayumi, T. Schimada, M. Suzuki, Occurrence of four depsipeptides, aeruginopeptins, together with microcystins from toxic cyanobacteria, Tetrahedron Letters 34 (1993) 6091-6094.
[10] K. Sivonen, K. Himberg, R. Luukkainen, S. I. Niemelä, G. K. Poon, G. A. Codd, Preliminary characterization of neurotoxic cyanobacteria blooms and strains from Finland, Environmental Toxicology and Water Quality 4 (1989) 339 – 352.
[11] K. J. James, I. R. Sherlock, M. A. Stack, Anatoxin-a in Irish freshwater and cyanobacteria – a new fluorometric liquid chromatographic method, Toxicon 35 (1997) 963-971.
[12] W. Carmichael, D. F. Biggs, M. A. Peterson, Pharmacology of Anatoxin-a, produced by the freshwater cyanophyte Anabaena flos-aquae NRC-44-1, Toxicon 17 (1979) 229-236.
[13] C. T. Thanh Binh, C. G. Peterson, T. Tong, K. A. Gray, J. F. Gaillard, J. J. Kelly, Comparing Acute Effects of a Nano-TiO2 Pigment on Cosmopolitan Freshwater Phototrophic Microbes using High-Throughput Screening, PLOS ONE 10 (2015) 1-18.
[14] J. Chen, Y. Qian, H. Li, Y. Cheng, M. Zhao, The reduced bioavailability of copper by nano-TiO2 attenuates the toxicity to Microcystis aeruginosa, Environ Sci Pollut Res 22 (2015) 12407–12414.
[15] R. Lu, P. Liu, X. Chen, Study the Toxicity to Microcystis aeruginosa Induced by TiO2 Nanoparticles Photocatalysis Under UV Light, B. Environ Contam Toxicol 94 (2015) 484–489.
[16] C. G. Horvarth, S. R. Lipsky, Use of liquid ion exchange chromatography for the separation of organic compounds, Nature 13 (1966) 748-789.
[17] A. M. Michalak i wps., Record-setting algal bloom in Lake Erie caused by agricultural and meteorological trends consistent with expected future conditions, PNAS 16 (2013) 6448–6452.
[18] I. Valiela, J. McClelland, J. Hauxwell, P. J. Behr, D. Hersh, K.Foreman, Macroalgal Blooms in Shallow Estuaries: Controls and Ecophysiological and Ecosystem Consequences, Limnology and Oceanography 5 (1997) 1105-1118.
[19] D. F. Boesch i wps., Harmful Alagal Blooms in Coastal Waters: Opinion for Prevention, Control and Mitigation, Noaa Costal Ocean Program 10 (1997).
[20] A. Kamiński, B. Bober, Z. Lechowski, J. Białczyk, Determination of anatoxin-a stability under certain abiotic factors, Harmful Algae 28 (2013) 83-87.

