Autor: Paulina Kęska
Luminescencja, tzw. zimne świecenie, jarzenie zachodzi w wyniku emisji fal świetlnych przez ciała (luminofory), wywołane czynnikiem wzbudzającym (innym niż rozgrzanie do wysokiej temperatury).
Ze względu na czynnik wzbudzający do świecenia, rozróżnia się następujące zjawiska [3]:
| chemiluminescencja | niektóre reakcje chemiczne |
| elektroluminescencja | stały lub zmienny prąd elektryczny |
| elektronoluminescencja | elektrony przyspieszanych napięciem między elektrodami |
| fotoluminescencja | pochłonięcie promieniowania elektromagnetycznego z obszaru widzialnego, ultrafioletu lub podczerwień |
| scyntycja | promieniowanie jonizujące |
| sonoluminescencja | ultradźwięki |
| termoluminescencja | podniesienie temperatury, jednak do niższej niż temperatura żarzenia |
| tryboluminescencja | czynnikiem mechanicznym, np. tarciem, zginaniem, ściskaniem |
Szczególnym przypadkiem luminescencji jest bioluminescencja – emitowanie fal świetlnych przez organizmy żywe.
Zjawisko bioluminescencji odkryto w 1947 roku, kiedy to McElroy wykazał, że ilość światła emitowanego podczas reakcji bioluminescencji jest wprost proporcjonalna do ilości ATP. Obecnie zjawisko wzbudza coraz większe zainteresowanie naukowców. Zdolność bioluminescencji przypisywana jest niektórym organizmom żyjącym w wodach morskich lub oceanicznych: ryby, pierwotniaki, meduzy, kałamarnice i rośliny. Zdolność emisji światła wykazują także niektóre żuki (świetliki), grzyby, bakterie i owady.
Emisja światła ma istotne znaczenie w życiu tych organizmów: służy do maskowania i ukrycia przed drapieżnikami, pomaga w lepszym komunikowaniu się, lepszym widzeniu w ciemności lub przyciąganiu zdobycz [1,2,8].
O bioluminescencji mówi się także w przypadku bakterii, gdzie jest ściśle związana z gęstością ich populacji oraz stanem metabolicznym. Bakterie luminescencyjne emitują światło, gdy znajdują się w optymalnym dla siebie środowisku. Z tego względu reakcja bioluminescencji wymaga dla prawidłowego przebiegu odpowiednich parametrów fizycznych (pH, temperatura) oraz obecności jonów Mg+2 lub innych jonów metali na X+2 stopniu utlenienia: Mn+2, Co+2, Fe+2, Ni+2 lub Zn+2. Luminescencja zachodzi w zakresie pH od 6,5 do 8,0, przy optimum wynoszącym 7,8-7,9. Wartość temperatury optymalnej związana jest z działaniem enzymu i wynosi ok. 25°C [2].
Obecnie bioluminescencja wykorzystywane jest także w nauce, gdzie stanowi podstawę działania różnorodnych czujników bioluminescencyjnych wykorzystano jako wskaźniki [4,7,8]:stężenia azotanów,potencjalnie rakotwórczych związków N-nitrozowych,węglowodorów aromatycznych,metali ciężkich,utleniaczy i antyutleniaczytoksycznych związków chemicznychobecności materiałów biologicznych, np. bakterii
Podstawą bioluminescencji jest reakcja utleniania związku zwanego lucyferyną przez lucyferazę. Lucyferyna to wspólna nazwa pigmentów zdolnych do emitowania światła na skutek reakcji utleniania indukowanej obecnością enzymu – lucyferazy. Lucyferazy o zróżnicowanej budowie posiadają m.in. świetliki świętojańskie (Lampyris noctiluca), ryby głębinowe i niektóre bakterie (rys.1).
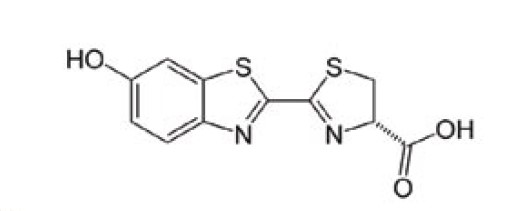
Rysunek 1. Lucyferaza świetlika świętojańskiego (Lampyris noctiluca) [2]
Bakterie wykazujące bioluminescencję posiadają zestaw genów zwany operonem lux. Luminescencja tych bakterii jest reakcją chemiczną, przebiegającą według ogólnego schematu:
FMNH2 + RCHO + O2 → FMN + RCOOH + H2O + hν (490nm)
Uściślając, w środowisku tlenowym lucyferaza łączy się z kofaktorem (zredukowanym mononukleotydem flawinowym – FMNH2) indukując przemianę aldehydu w kwas tłuszczowy, a sama przechodzi w stan wzbudzony (o wyższym poziomie energetycznym). W wyniku utleniania powstaje cząsteczka w stanie wzbudzonym- oksylucyferyna. Jako ze stan wzbudzony jest stanem nietrwałym, oksylucyferyna powracając do stanu podstawowego czemu towarzyszy emisja promieniowania w zakresie widzialnym widma elektromagnetycznego (światło o długości fali 490 nm, zielono-niebieskie). Kofaktor zaś ulega utlenieniu do mononukleotydu flawinowego (FMN) (rys.2).
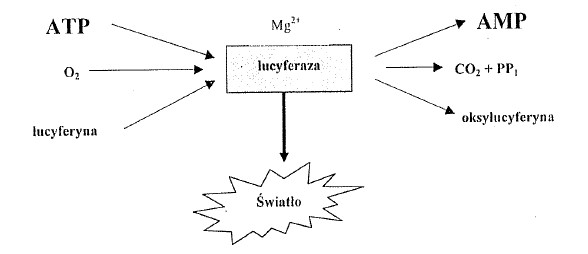
Rysunek 2. Reakcje zachodzące podczas bioluminescencji bakterii i schemat [5]
W każdej żywej komórce oraz materiałach pochodzenia biologicznego obecny jest ATP. Jedna komórka bakteryjna zawiera przeciętnie femtogram (10-15 g) ATP. Bakterie Gram(+) zawierają około 10 razy więcej ATP niż bakterie Gram(-), natomiast spory bakteryjne nie zawierają go wcale. Komórki drożdżowe wykazują średnio około 100 razy więcej ATP niż komórki bakteryjne (tab.1).
Tabela 1. Zawartość ATP w komórkach różnych mikroorganizmów [6]
| MIKROORGANIZMY | ATP[fg/komórkę] | |
| BAKTERIE | Lactobacillus spp. | 2,0-2,2 |
| Pseudomonas fluorescens | 0,6 | |
| Escherichia coli | 1 | |
| DROŻDŻE | Kloeckera apiculata | 48,5 |
| Pichia membranaefaciens | 90,7 | |
| Torulopsis sp. | 144 | |
| Saccharomyces cerevisiae | 155 | |
Efekt bioluminescencji wykorzystywany jest w systemach lumenometrycznych. Luminometria opiera się na przemianach hydrolitycznych adenozyno-5′-trifosforanu (ATP) do adenozyno-5′-difosforanu (ADP) i ortofosforanu lub do Adenozyno-5′-monofosforanu (AMP) i pirofosforanu. W efekcie uwalniana jest pewna ilość energii swobodnej w postaci kwantu światła. Wielkość emisji światła jest wprost proporcjonalna do stężenia limitowanego reagenta. W przypadku, gdy w kompleksie ATP/lucyferyna-lucyferaza całkowita objętość mieszaniny reakcyjnej jest stała, jest to ATP. Zatem intensywność świecenia będzie proporcjonalna do ilości ATP (pochodząca żywej komórki lub materiału biologicznego).
Wielkość emisji światła powstającego w reakcji luminescencji mierzona jest za pomocą lumenometru, wyrażona jako RLU (ang. relative light unit). Ogólna budowa luminometru obejmuje komorę pomiarową (zawierającą naczynie reakcyjne, np. kuwetę, mikropłytkę), detektor, układ przetwarzający sygnał optyczny na elektryczny i wyświetlacz ukazujący wynik. Naczynie reakcyjne lumenometru musi być chronione przed światłem zewnętrznym, by zminimalizować możliwe zakłócenia pomiaru, oraz maksymalnie zbliżona do detektora w celu maksymalizacji efektu optycznego, pozwalającego na szybki i precyzyjny pomiar. Detektor luminometru stanowią fotodiody oraz przewody PMTs (ang. photomultipler tubes) umożliwiające amplifikację – kaskadę elektronów wzbudzoną przez foton emitowanego światła [1,5,6].
Pobieranie próbek do oznaczeń lumenometrycznych odbywa się za pomocą wymazówki, bezpośrednio przed pobraniem wymazu nasączanej sterylnym roztworem NaCl. Końcówkę wymazówki należy umieścić w odczynniku i wstrząsnąć W pierwszym etapie analizy dochodzi do destrukcji struktury komórkowej materiału biologicznego pod wpływem detergentów. W rezultacie uwolnianie jest ATP z jakiejkolwiek bakterii obecnej w badanym materiale. W dalszej kolejności angażowane są odczynniki niezbędne do zajścia reakcji – lucyferyna oraz lucyferaza.
Stechiometryczna zależność między ilością ATP, a intensywnością świecenia sprawiło, że bioluminescencja traktowana jest jako szybka metoda wykorzystywana do oznaczeń mikrobiologicznych. Podczas badań próbek żywności z użyciem luminometru najważniejszym problemem jest odróżnienie ATP pochodzącego z bakterii od ATP pochodzącego od innego materiału biologicznego, np. resztek pożywienia. Stanowic to może jednak zaletę metody, na przykład podczas badania skuteczności mycia i dezynfekcji powierzchni, kontroli stanu higienicznego powierzchni produkcyjnych lub monitoringu w ramach systemu HACCP.
Ponadto luminometria, w porównaniu do innych technik analitycznych, charakteryzuje się dużą czułością i dokładnością pomiarów, szerokim zakresem dynamicznym oraz stosunkowo niskim kosztem aparatury [3,5,8].
Bibliografia:
- Calvert R.M., Hopkins H.C., Reilly M. J., Forsythe S. J. (2000). Caged ATP—an internal calibration method for ATP bioluminescence assays. Letters in applied microbiology, 30(3), 223-227.
- Choma I.M. (2010). Bioluminescencja, czyli analiza ukierunkowana na efekt. LAB Laboratoria, Aparatura, Badania, 15, 8-14.
- https://pl.wikipedia.org/wiki/Luminescencja
- Jakubus M.B. Natalia Tatuśko N. 2015. Przegląd wybranych biologicznych metod oceny stanu środowiska naturalnego. Inżynieria Ekologiczna, 42, 78-86.
- Kołożyn-Krajewska D. Oznaczanie ATP z wykorzystaniem bioluminescencji. W:Higiena Produkcji Żywności. Wyd. SGGW, Warszawa 2007, 104-106.
- Kręgiel, D. 2011. Zastosowanie luminometrii w badaniach adhezji drobnoustrojów do powierzchni abiotycznych. LAB Laboratoria, Aparatura, Badania, 16, 10-14.
- Pogorzelec M., Piekarska K. 2013. Wykorzystanie bakterii bioluminescencyjnych do wykrywania substancji toksycznych i mutagennych w środowisku. Interdyscyplinarne zagadnienia w inżynierii i ochronie środowiska. Wrocław 2013. Tom 3, 524–528.
- Rygała A., Kręgiel D. 2015. Przydatność pomiaru ATP w badaniach mikrobiologicznych. Przemysł Spożywczy 69 (10), 20-23.
Photo credit: NOAA Ocean Explorer via Source / CC BY-SA
Photo credit: Norfolk Biodiversity Information Service via Foter.com / CC BY

