Autorką artykułu jest Elwira Smakowska – studentka biotechnologii na Uniwersytecie Wrocławskim.
Interferencja RNA to stary ewolucyjnie i szeroko rozpowszechniony wśród organizmów system regulacji pracy genów, pełniący rolę swego rodzaju „strażnika” genomu. Mimo iż tak powszechne, zjawisko to przez wiele lat umykało uwadze naukowców, ponieważ nikt nie przypuszczał, że aby móc wyłączyć gen należy zgładzić jego posłańca, czyli mRNA, cząsteczkę pośredniczącą w przepływie informacji pomiędzy danym genem a jego produktem.
Odkrycie zjawiska wyciszania genów za pomocą krótkich fragmentów dwuniciowego RNA datuje się na rok 1990, kiedy to grupa naukowców m.in. Richard Jorgensen oraz Carolyn Napoli z Uniwersytetu w Arizonie, chciała w nieznaczny sposób poprawić naturę. Jorgensen wraz ze swoim zespołem badawczym zaplanował wyhodowanie takiej odmiany petunii ogrodowej (Petunia hybryda), aby jej kwiaty miały barwę ciemniejszą aniżeli odmiana pospolita. Przeprowadzone doświadczenie polegało na wprowadzeniu do komórek roślinnych dodatkowej kopii genu syntazy chalkonowej, odpowiedzialnej za syntezę fioletowego barwnika. Wynik tego doświadczenia był niezmiernie zaskakujący, ponieważ naukowcy spodziewając się kwiatów o barwie ciemniejszej, otrzymali rośliny o kwiatach białych, lub też posiadających białe plamki.
Wprowadzenie zatem dodatkowej kopii genu wcale nie przyczyniło się do podniesienia poziomu syntezy barwnika przez syntazę chalkonową. W pewien sposób, wtedy jeszczeniewytłumaczalny, doszło do zablokowania ekspresji genu dla enzymu odpowiedzialnego za syntezę barwnika.
Chcąc rozwikłać tą zagadkę naukowcy postanowili zmierzyć poziom mRNA genu dla syntazy chalkonowej w komórce roślinnej. Okazało się, ze poziom mRNA obniżył się. Był to dosyć zaskakujący wynik, a jednocześnie mógł być wytłumaczeniem dla tego niespodziewanego rezultatu. W jakiś sposób, nastąpiło >wyciszenia ekspresji genu po tym jak do komórki została wprowadzona jego dodatkowa kopia. Zjawisko to nazwano kosupresją.
Wielki przełom w tej dziedzinie nastąpił w 1998 roku, kiedy to Andrew Z. Fire oraz Craig C. Mello opublikowali na łamach tygodnika „Nature” wyniki swoich kilkuletnich badań, w których organizmem modelowym był nicień Caenorhabditis elegans. Naukowcy poznali i opisali podstawy molekularnego mechanizmu, nazwanego przez nich interferencją RNA. Badacze wstrzykiwali nicieniom cząsteczki mRNA kodujące jedno z białek mięśni, jednak nie wywoływało to zmian w zachowaniu robaków (Rys.1). Wprowadzenie antysensownego fragmentu, który mógł wiązać się komplementarnie z mRNA, również nie wywołało zmian. Dopiero po wstrzyknięciu sekwencji zarówno sensownych jak i antysensownych naukowcy zaobserwowali, że nicienie dostawały „drgawek”. Podobne zaburzenia występowały u robaków, których DNA nie posiadał sprawnego genu odpowiedzialnego za wytworzenie badanego białka.
W jaki sposób wytłumaczono to zjawisko? Naukowcy doszli do wniosku, że sensowne i antysensowene sekwencje RNA łączą się tworząc podwójną nić RNA. Takie właśnie dwuniciowe fragmenty RNA są w stanie wyciszyć dany gen, zatem zjawisko interferencji RNA może dotyczyć jedynie genu o sekwencji identycznej z sekwencją wprowadzonych cząsteczek RNA. Pojawia się wiec oparty o podobne mechanizmy system regulacji ekspresji genów jak u petunii ogrodowej.
Za swoje osiągnięcia otrzymali 2 października 2006 roku Nagrodę Nobla w dziedzinie medycyny i fizjologii. W uzasadnieniu swojego wyboru Komisja podkreśliła, że: „Dzięki badaniom i odkryciom tegorocznych laureatów poznano fundamentalny mechanizm kontroli przepływu informacji genetycznej”.
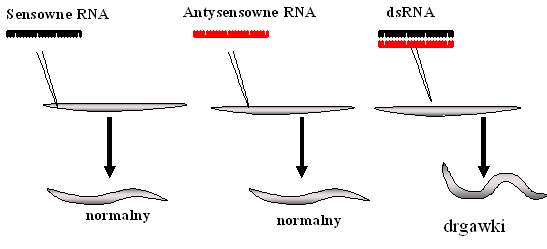
Rys.1 Efekt fenotypowy po wprowadzeniu do C.elegans dwuniciowego fragmentu RNA. Tylko dsRNA, homologiczny do genu kodującego jedno z białek mięśni powodował zahamowanie syntezy tego białka, czyli wyciszenie ekspresji genu. W konsekwencji u nicieni pojawiły się „drgawki”.
(Zmodyfikowany na podstawie Nobelprize.org., http://nobelprize.org/nobel_prizes/ medicine/laureates/2006/adv.html).
Kolejnym krokiem umożliwiającym głębsze poznanie mechanizmów uczestniczących w procesie wyciszania genów było scharakteryzowanie białka – rybonukleazy III, zwanej również Dicer, biorącego udział w przetwarzaniu dsRNA (ang. double – stranded RNA), cząsteczki złożonej z dwóch komplementarnych nici RNA, w krótsze 21-23 nukleotydowe fragmenty siRNA (ang. small interfering RNA). Molekularne podstawy tego zjawiska badano u Drosophila melanogaster.
W tym samym czasie inny zespół badawczy zajął się poznawaniem mechanizmów RNAi w komórkach ssaczych (pracowano na komórkach mysich i chomiczych). Uwieńczeniem badań w 2002 była obszerna publikacja w „Nature” potwierdzająca obecność mechanizmu wyciszania genów w komórkach ssaczych.Bardzo dobrze poznano molekularne podstawy transkrypcyjnego wyciszania genów i co więcej, pojawiły się pierwsze wzmianki o towarzyszącej temu procesowi metylacji DNA.
W maju 2006 ogłoszono zakończenie mapowania chromosomu 1 – największego z ludzkich chromosomów, jednocześnie było to zakończenie mapowania całego ludzkiego genomu w ramach Projektu Poznania Ludzkiego Genomu (HGP). Tak wiec przyszedł czas na odczytanie zawartej w nim informacji. Naukowcy zaczęli analizować geny i pełnione przez nie funkcje, przy wykorzystaniu interferencji RNA. Niedługo przed ogłoszeniem wyników wieńczących prace nad Projektem HGP, zespół badawczy Hiroaki Kawasami potwierdził występowanie w komórkach ludzkich transkrypcyjnego wyciszania genów i związanej z nim metylacji DNA.
Następne lata przyniosły ogromną lawinę informacji na temat możliwości modyfikacji DNA połączonych z transkrypcyjnym wyciszaniem genów. A to był dopiero początek. Otrzymaliśmy nowe narzędzie umożliwiające regulację ekspresji genów i nowe nadzieje na rozwój terapii genowych.
Regulatorowe cząsteczki RNA jako induktor potranskrypcyjnego wyciszania genów
Wyciszanie indukowane za pomocą dsRNA, może odbywać się na dwóch poziomach:
* Transkrypcyjnym – jego efektem jest zmniejszenie wydajności syntezy mRNA lub też całkowite zahamowanie transkrypcji. Mówimy wtedy o transkrypcyjnym wyciszaniu genów – TGS (ang. Transcriptional Gene Silencing).
* Potranskrypcyjnym – dochodzi do specyficznej degradacji docelowego mRNA przy udziale homologicznych sekwencji krótkich fragmentów RNA, a proces nazywany jest potranskrypcyjnym wyciszaniem genów PTGS (ang. Post-transcriptional Gene Silencing).
Organizmami, u których po raz pierwszy zaobserwowano zjawisko interferencyjnego wyciszania genów były organizmy roślinne (Petunia hybryda), ale obecnie wiemy doskonale, że występuje ono zarówno u pierwotniaków, nicieni, owadów jak i w komórkach ssaczych, w tym u człowieka. Proces wyciszania ekspresji genów u roślin nazywany jest kosupresją, lub częściej PTGS (np. Arabidopsis thaliana), u zwierząt RNAi (Drosophila melanogaster), natomiast u grzybów określany jest mianem quellingu (Neurospora Crassa).
Pomimo tego, że kosupresja (PTGS), RNAi oraz quelling zachodzą w tak różnych organizmach, posiadają trzy cechy wspólne. We wszystkich przypadkach induktorem wyciszenia jest dsRNA. Ponadto docelowa cząsteczka mRNA degradowana jest w procesie opartym o homologie sekwencyjnąz siRNA. Trzecie podobieństwo to „białkowa maszyneria” umożliwiająca zajście procesu wyciszenia genów. Dodatkowo, tym co łączy mechanizmy wyciszania u wszystkich organizmów jest ich funkcja w regulacji ekspresji genów – obrona przed inwazją mobilnych elementów genomu, bądź też obrona przed obcym np. wirusowym materiałem genetycznym.
Powstawanie siRNA
Sygnałem do uruchomienia transkrypcyjnego i potransrypcyjnego wyciszania genów jest pojawienie się dwuniciowych fragmentów RNA. Możemy doszukać się kilku sposobów, za pomocą których dsRNA generowany jest w komórce, zarówno w jądrze jak i w cytoplazmie. Jednym z nich jest powstawanie podwójnych fragmentów RNA podczas transkrypcji odwróconych powtórzeń.Nieco odmienny mechanizm obserwujemy w przypadku tzw. „ruchomych elementów genetycznych”, gdzie synteza dsRNA, odbywa się za pośrednictwem polimerazy RNA zależnej od RNA (RdRP – ang. RNA – Dependent RNA Polymerase), która dobudowuje nić komplementarną do powstałego z tych elementów transkryptu. Jeszcze inny mechanizm indukcji wyciszania ekspresji genów związany jest z błędną transkrypcją, do której może dojść w jądrze komórkowym. W wyniku tego powstaje RNA, posiadający jakiś „defekt”, czyli tzw. abRNA (ang. aberrant RNA). Jest on zagrożeniem dla komórki, ponieważ mogą powstać z niego niewłaściwe produkty syntezy białka. Aby temu zapobiec, komórka używając tego abRNA jako matrycy dobudowuje drugą komplementarną nić przy udziale RNA zależnej polimerazy RNA (RdRP), w konsekwencji powstaje siRNA, który generuje wyciszenie niefunkcjonalnego RNA. Inną możliwością jest synteza dsRNA w odpowiedzi na zakażenie wirusem, kiedy to dsRNA powstaje przy pomocy wirusowej RdRP na matrycy będącej genomem wirusa.
Zatem jeśli wiadomym jest, jakie mogą być przypuszczalne źródła dsRNA, przetwarzanego następnie do krótkich 21-26 nukleotydowych fragmentów siRNA, należy w tym miejscu powiedzieć nieco na temat samych cząsteczek siRNA. Można wśród nich wyróżnić dwie populacje:
* Krótsze 21-22 nukleotydowe fragmenty, które odpowiedzialne są w komórce za degradację mRNA.
* Dłuższe 24-26 nukleotydowe fragmenty, którym przypisuje się udział w transkrypcyjnym wyciszaniu genów oraz w modyfikacji chromatyny
Bez względu na pochodzenie i rodzaj każda cząsteczka siRNA powstaje w procesie fragmentacji dsRNA przy udziale rybonukleazy typu III. Ponadto każda posiada na swoim 5’ końcu grupę fosforanową, natomiast 3’ koniec opatrzony jest dwoma niesparowanymi nukleotydami z wolna grupą hydroksylową.
Białkowa maszyneria PTGS
Charakterystyczne czynniki białkowe odpowiedzialne za prawidłowy przebieg wyciszania za pomocą homologicznych siRNA, zlokalizowano zarówno u N. crassa, D. melanogaster jak i u Arabidopsis czy ssaków. Odznaczają się bardzo dużą wzajemną homologią, zarówno pod względem funkcjonalnym jak i strukturalnym. Spróbujmy, zatem dokonać podziału tych komponentów:
1. Element inicjujący: Dicer
Jest białkiem dokonującym specyficznego cięcia dsRNA do krótszych 21-26 nukleotydowych fragmentów. Dicer złożony jest z domen zróżnicowanych pod względem funkcjonalnym: N- końcowej domeny o aktywności helikazowej, domeny wiążącej dsRNA, domeny PAZ (110 aminokwasowa domena obecna w białkach takich jak PIWI, Ago, Zwille/Pinhead) oraz dwóch tandemowych domen RNazy III.
2. Element wzmacniający: RdRP
RNA zależna polimeraza RNA (RdRP) jest czynnikiem odpowiedzialnym za podnoszenie poziomu siRNA podczas procesu wyciszania danego genu. Dzięki jej aktywności abRNA jest przekształcany w dsRNA, który zostanie potem zdegradowany do siRNA zdolnego do wyciszenia docelowego genu. RdRP może również produkować dsRNA z fragmentów mRNA, które zostały już przecięte przez kompleks zawierający komplementarny fragment siRNA. Jeśli natomiast komórka odpiera atak wirusowego materiału genetycznego, to wtedy taki wirusowy RNA przekształcany jest za pomocą specjalnej wirusowej vRdRP do formy dwuniciowego RNA.
3. Element efektorowy: RISC
RISC (ang. RNA Induced Silencing Complex) jest kompleksem o aktywności nukleazowej, którego niezbędnym elementem jest siRNA. Wykazano, że małe cząsteczki RNA zasocjowane z owym kompleksem odpowiedzialne są za sekwencyjno – specyficzne oddziaływanie z docelowym fragmentem mRNA, co w konsekwencji umożliwia jego cięcie przez element nukleazowy kompleksu RISC. Najważniejszym jego składnikiem jest białko należące do rodziny Argonaute (AGO), posiadające aktywność endonukleazy. AGO posiada dwie charakterystyczne domeny PAZ oraz PIWI, odpowiedzialne za transfer siRNA z rybonukleazy Dicer do kompleksu RISC, wiązanie siRNA i w konsekwencji cięcie mRNA.
Głównym zadaniem siRNA w kompleksie RISC jest rozpoznanie docelowego fragmentu RNA, który ma ulec degradacji. Tylko jedna nić z cząsteczki siRNA zostaje skierowana do białka Ago. Selekcja określająca, która to ma być nić odbywa się zgodnie z regułą asymetrii, która mówi o tym, że do kompleksu Ago włączana jest nić posiadająca na swoim 5’ końcu resztę fosforanową przy mniej stabilnym zakończeniu dupleksu siRNA. Ufosforylowany 5’ koniec dopasowywany jest do zasadowej kieszeni białka PIWI, natomiast PAZ przyłącza dwa wolne nukleotydy znajdujące się na 3’ końcu. Druga nić pochodząca z dupleksu siRNA zostaje usunięta jeszcze przed degradacją mRNA.
Dwustopniowy mechanizm interferencji RNA
Wnikliwe badania nad różnymi mechanizmami interferencji RNA dowodzą, że proces ten przebiega dwustopniowo. Pierwszy etap jest krokiem inicjującym i obejmuje on powstanie, a następnie fragmentację dsRNA, w wyniku czego powstają 21-26 nukleotydowe fragmenty RNA. Matrycą do produkcji dsRNA, może być wirusowy RNA, odwrócone powtórzenia, transgeny, bądź też wprowadzona do komórki syntetyczna cząsteczka dsRNA. Krótkie fragmenty siRNA powstają w wyniku cięcia dsRNA przez RNAzę III Dicer.
Jak wiemy 5’ koniec każdej cząsteczki siRNA posiada grupę fosforanową, zatem musi na tym etapie działać również jakaś kinaza umożliwiająca fosforylację RNA.
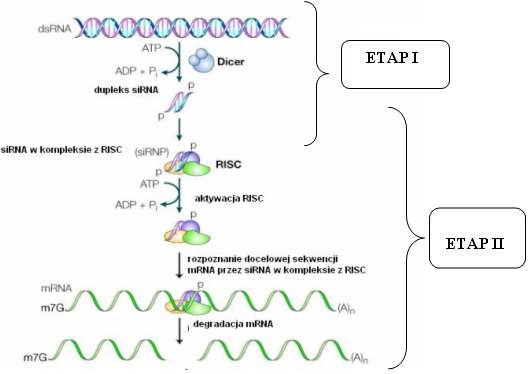
Rys.2 Dwustopniowy model mechanizmu wyciszania genów indukowanego przez dsRNA
(Zmodyfikowano na podstawie: http://www.weizmann.ac.il/home/csyakob/current.html).
Natomiast w drugim etapie siRNA wchodzi do kompleksu RISC i w oparciu o homologię sekwencyjną doprowadza do degradacji mRNA. Jeśli powstałoby zbyt mało cząsteczek siRNA i wyciszanie przebiegałoby nieefektywnie, jest możliwość namnożenia tych cząstek, dzięki aktywności RdRP.
Cząsteczki siRNA doprowadzają nie tylko do degradacji odpowiedniego fragmentu mRNA, ale mogą również przyczyniać się do kowalencyjnych modyfikacji sekwencji DNA oraz histonów.
Literatura:
Matzke M. A, Matzke A. J. M., 2004. Planting the Seeds of a New Paradigm. PLoS Biol 2 (5): e133
Fire A, Xu S, Montgomery M, Kostas S, Driver S, Mello C 1998. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans.Nature 391, 66-69
Kawasaki H., Taira K., 2004: Induction of DNA methylation and gene silencing by short interfering RNAs in human cells. Nature, 431, 211-217.
Matzke M., Matzke J. M., Kooter J., 2001. RNA: Guiding Gene Silencing; Science, 293(5532):1080-3
Mathieu O., Bender J., 2004. RNA-directed DNA methylation; Journal of Cell Science 117, 4881-4888
Paprocka M., Wołoszyńska M., 2004. Potranskrypcyjne wyciszanie genów u roślin Kosmos 2 (263), s. 193-200
Agrawal N, Dasaradhi PV, Mohmmed A, Malhotra P, Bhatnagar RK, Mukherjee SK., 2003, RNA Interference: Biology, Mechanism, and Applications; Microbiol Mol Biol Rev, 67(4):657-85
Franck Vazquez, 2006. Arabidopsis endogenous small RNAs: highways and byways.Trends in Plant Science 9: 460-468

