
Fot. CIAT International Center for Tropical Agriculture (CC BY-SA 2.0)
Zagadnienie hodowli organów i tkanek roślinnych in vitro po raz pierwszy sformułował w 1902 roku Haberlandt. Jednak prowadzone przez niego prace nie dały pozytywnych wyników. Między 1907 rokiem a 1909, Harrison, Burrows i Carrel z powodzeniem uzyskali hodowlę ciągłą komórek zwierzęcych i tkanek ludzkich. Dopiero w 1934 roku White utrzymał przy życiu i uzyskał wzrost tkanki pomidora (Lycopersicon esculentum) w warunkach in vitro. Z kolei w 1939 roku uzyskano po raz pierwszy nieograniczony wzrost tkanki roślinnej. Od tamtej chwili znacznie wzrosła ilość doświadczeń z użyciem hodowli tkanek z różnych części roślin. Odkrycie w XX wieku wpływu auksyn na wzrost i podziały komórek przyspieszyło jeszcze bardziej badania. Pierwszą odkrytą auksyną był IAA (kwas indolilooctowy). W 1946 roku Ball doprowadził do odtworzenia całej rośliny tytoniu (Nicotiana tabacum) z wierzchołka wzrostu. Równocześnie prowadzono badania nad możliwością skrócenia okresu spoczynku nasion oraz organogenezą kalusa. W Polsce doświadczenia nad kulturami in vitro zapoczątkował prof. dr Jerzy Czosnowski. Badał fizjologię różnych typów hodowli tkanek oraz zajmował się izolowanymi zarodkami. Komercyjne wykorzystanie kultur in vitro do rozmnażania roślin, głównie ozdobnych stało się możliwe od roku 1965, kiedy Murashige opracował efektywny sposób klonalnego rozmnażania storczyków. Jego metodę zaczęto stosować do innych gatunków roślin.
Czym są kultury in vitro roślin?
Czym w zasadzie są kultury in vitro? To hodowla komórek, tkanek lub fragmentów organów roślinnych, prowadzona w naczyniach szklanych, na specjalnie dobranych pożywkach, w ściśle kontrolowanych, sterylnych warunkach.
Aby zrozumieć w pełni mechanizm kultur tkankowych, a także regeneracji roślin, warto przybliżyć sobie zagadnienia związane z ich zdolnością morfogenetyczną. Przede wszystkim komórki roślinne są totipotentne, czyli posiadają nieograniczone zdolności do dzielenia się i odtwarzania poszczególnych organów i całego organizmu. Właściwość ta została po raz pierwszy opisana, jako element teorii komórkowej, w pierwszej połowie XIX wieku przez niemieckich naukowców – Schleiden, Shwann i Virchow. Dawniej, w in vitro do wywołania totipotencji stosowano, bogate w składniki odżywcze i substancje wzrostowe, płynne bielmo (mleczko kokosowe, mleczko kukurydziane lub bielma z niedojrzałych nasion Ginko). Naturalne składniki mogą być zastąpione pożywkami otrzymanymi syntetycznie o zoptymalizowanym składzie. Oczywiście nie jest tak, że zdolności regeneracyjne wszystkich komórek są takie same. Zależy to od wielu czynników, a mianowicie: wieku komórek, ogólnej kondycji tkanki, stopnia zróżnicowania i specjacji. Również tkanki tego samego organu mogą wykazywać różnice w regeneracji, np. tkanki górnej części korzenia marchwi (Daucus carota) regenerują lepiej niż te same tkanki pobrane z części dolnej. Komórki wykorzystywane w kulturach powinny posiadać żywotne jądro, nie uszkodzone błony plazmatyczne i niezbyt grube ściany.
Różnicowanie się komórek, inaczej dyferencjacja może nastąpić drogą organogenezy bezpośredniej i pośredniej. Pierwsza polega na wykształceniu organów roślinnych, bez stadium przejściowego, bezpośrednio z wyłożonych na pożywce tkanek bądź z zawiesiny komórek. Z kolei organogeneza pośrednia, zawiera etap przejściowy w postaci wytworzenia tkanki kalusowej, w której następnie wytworzą się centra komórek merystematycznych (Merystem to tkanka twórcza, gdzie zachodzą intensywne podziały komórkowe, co powoduje powstawanie organów roślinnych). Nie wszystkie komórki kalusa mają jednakowe możliwości rozwojowe. Niektórzy badacze uważają, że kalus to struktura składające się z komórek kompetentnych i niekompetentnych, co powoduje zróżnicowany wzrost rośliny. Tłumaczy to zjawisko zachodzące w hodowlach tkanek, gdzie wydajność morfogenezy nie jest jednolita, mimo że tkanki pochodzą z tych samych części roślin.

Fot. CIAT International Center for Tropical Agriculture (CC BY-SA 2.0)
Warunki prowadzenia kultur in vitro
Organizacja pomieszczeń laboratoryjnych zależy od wielkości przetwarzanego materiału roślinnego oraz organizacji pracy. Istnieje jednaj najważniejsza zasada, a mianowicie elementy sterylne muszą być oddzielone od niesterylnych. Wszystkie pomieszczenia powinny być utrzymywane w czystości. Trzeba zapewnić optymalne warunki do wzrostu roślin. Do tego celu buduje się specjalne pomieszania, gdzie można kontrolować temperaturę wzrostu, wilgotność oraz fotoperiod. Są to tak zwane fitotrony.
Po zebraniu materiału należy przeprowadzić jego sterylizację. Proces musi być przeprowadzony bardzo starannie, gdyż w przypadku błędów zakażeniu może ulec cała hodowla. Środki do dezynfekcji powinny być tak dobrane, aby niszcząc patogeny nie uszkodziły eksplantatu. Najczęściej do jałowienia materiału roślinnego używa się: roztworu podchlorynu wapnia, roztworu podchlorynu sodu, wodę bromową, wodę utlenioną, alkohol etylowy czy handlowe preparaty Domestos lub Ace.
Kultury prowadzi się najczęściej na płytkach Petriego, kolbach stożkowych lub probówkach. Szkło i używane narzędzia należy poddać sterylizacji w suszarce lub autoklawie. Przed izolacją eksplantatów trzeba wyjałowić również pożywki. Izolację materiału roślinnego wykonuje się w warunkach sterylnych, na stole z laminarnym przepływem powietrza, zapewniając w ten sposób sterylność prac. Zakażenia ujawniające się na pożywce i eksplantatach są spowodowane obecnością patogenów oraz saprofitów, których nie wyeliminowano podczas dezynfekcji lub błędów popełnionych w późniejszych etapach hodowli.
Należy używać wyłącznie wody o wysokiej czystości w procedurach hodowli tkankowej. Woda podwójnie destylowana lub dejonizowana są również dopuszczalne. Woda nie powinna być przechowywana, ale natychmiast wykorzystana. Regularna konserwacja i monitorowanie urządzeń do oczyszczania wody są konieczne. Oczyszczona woda do hodowli tkanek jest również dostępna komercyjnie.
Pożywki dla kultur in vitro
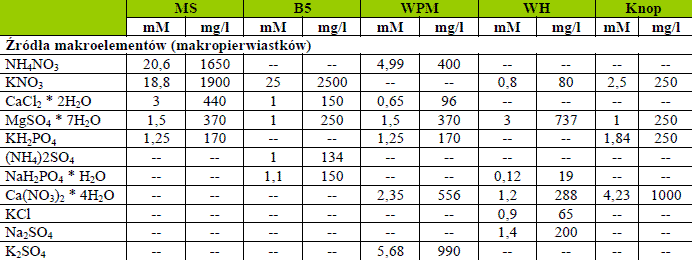
Pożywka, na którą wykłada się ekplantaty musi dostarczać niezbędne do wzrostu i rozwoju związki mineralne (makro- i mikroelementy), źródło energii i węgla, witaminy, organiczny azot i regulatory wzrostu. Mają one znaczenie w przerywaniu spoczynku i indukcji podziałów komórek, ale również wiele czynników fizycznych pożywki ma wpływ na powodzenie kultury. Przede wszystkim jeśli składniki są rozpuszczone w wodzie destylowanej mamy do czynienia z pożywką płynną, bądź stałą, gdy jest zestalona agarem. O stopniu zestalenia decyduje zawartość procentowa agaru, a to z kolei wiąże się z potencjałem wodnym pożywki. Po rozpuszczeniu wszystkich składników w wodzie redestylowanej lub dejonizowanej mierzy się pH pożywki. Optymalna wartość waha się między 5 – 6. W inicjacji podziałów komórkowych i wzrostu kalusa światło nie jest najistotniejsze. Jest wiele rodzajów pożywek i ich modyfikacji. Do najbardziej znanych należą: Gauthereta (1942), Hildebrandta i in. (1946), Nitcha (1951), Hellera HE (1953), Reinerta, White’a (1956), Murashige i Skoog’a MS (1962), Linsmaier’a i Skoog’a LS (1965), Gamborga i in. B5 (1968), Philips’a i Collins’a L2 (1979).
Składniki pożywek do prowadzenia kultur in vitro
Eksplantat, który hodujemy potrzebuje do wzrostu i rozwoju wszystkich niezbędnych pierwiastków. Spośród 90 pierwiastków występujących w przyrodzie roślina potrzebuje zaledwie kilkunastu z nich. W zależności od gatunku i jego potrzeb ustala się odpowiednie stężenia składników.
Makroelementy w pożywkach
Jak wskazuje nazwa ilość dostarczanych składników z tego rodzaju musi być wysoka, aby wzrost i rozwój roślin zachodził prawidłowo. Azot, fosfor, potas, magnes, wapń i siarka (węgiel podawany jest w postaci organicznej) są zwykle uważane za makroelementy, które zazwyczaj występują w co najmniej 0,1% suchej masy.
Azot
Azot jest najważniejszy dla rośliny. Większość nieorganicznego azotu jest konwertowany do aminokwasów, a następnie do białek. Ilość nieorganicznego azotu w pożywce waha się 25 – 60 mM. Najczęściej dostarczany w postaci jonów azotanowych (KNO3) i amonowych (NH4NO3). Zawartość całkowita jak i względna jest bardzo istotna. Teoretycznie korzystne jest dostarczanie azotu pod postacią jonów amonowych, jako że azot musi być w formie zredukowanej by być wbudowanym w makromolekuły. W wysokich stężeniach jony amonowe mogą być toksyczne dla tkanek roślinnych np. powodować witryfikację zarodków (zeszklenie, nie nadają się wtedy do prowadzenia dalszej kultury), a absorbcja ich przez rośliny powoduje zakwaszenie podłoża. Dlatego stosowanie ich jako jedyne źródło azotu, wiąże się ze stabilizacją pH pożywki.
Potas
Jest ważnym dla rośliny jonem o ładunku dodatnim. Chociaż wymagana ilość potasu jest bardzo zróżnicowana w zależności od gatunku, stężenie potasu w pożywkach waha się od 20-30 mM.
Fosfor
Jest integralną częścią kwasów nukleinowych i innych związków strukturalnych. Dodawany jest jako sole amonowe, sodowe lub potasowe, w stężeniach 1-3 mM. Zbyt duże stężenie fosforu może prowadzić do wytrącania się składników podłoża w postaci nierozpuszczalnych fosforanów.
Wapń
Wapń jest kofaktorem wielu enzymów i pełni szczególnie ważną rolę w syntezie ściany komórkowej. Jest on dostarczany głównie jako chlorek wapnia lub azotan wapnia, stężeniach w zakresie od 1 do 3 mM. W kulturach roślin, niedobór wapnia może doprowadzić do martwicy wierzchołka pędu.
Magnez
Ma zasadnicze znaczenie dla funkcjonowania enzymów, jest integralną częścią cząsteczki chlorofilu. Zwykle jest dodawany w postaci siarczanu magnezu, w stężeniach zbliżonych do wapnia.
Siarka
Siarka jest częścią kilku aminokwasów i odgrywa ważną rolę w strukturze białka. Dostarczana jest jako jon SO4-, w stężeniach 1-3 mM.
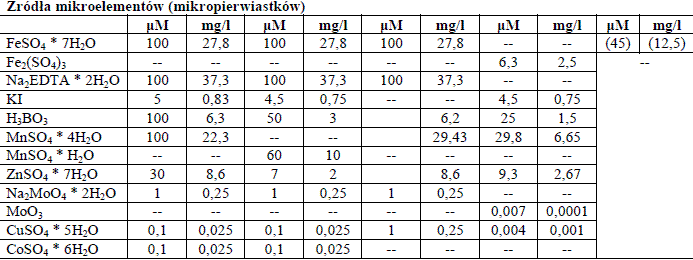
Mikroelementy w pożywkach
Są niezbędne w ilościach śladowych i pełnią różnorodne funkcje. Należą tu: mangan, jod, miedź, molibden, bor, żelazo, kobalt, i cynk. Czasem w niektórych przepisach wykorzystuje się jeszcze glin i nikiel.
Żelazo
Żelazo jest niezbędne do syntezy chlorofilu oraz pełni funkcję w wielu reakcjach utleniania i redukcji. Na ogół występuje w pożywkach w stężeniach 1 µM. Głównym problemem w dostarczaniu żelaza in vitro jest to, że tworzy nierozpuszczalne związki w zasadowym pH, problem ten jest szczególnie widoczne w hodowli płynnej, gdzie można zauważyć osad. Jest zazwyczaj dodawane jako siarczan żelaza, choć spotyka się również cytrynian żelaza. EDTA (kwas etylenodiaminotetraoctowy) jest dodawany w połączeniu z siarczanem żelaza. Kompleksy, które powstają po połączeniu żelaza i EDTA umożliwiają powolne i ciągłe uwalnianie się żelaza z podłoża. Ułatwia to wnikanie żelaza do tkanek roślinnych w szerszym zakresie pH. W innym przypadku nastąpiłoby wytrącenie się jonów żelaza z pożywki w postaci tlenku żelaza.
Mangan
Mangan jest potrzebny do reakcji enzymatycznych, szczególnie w procesach oddychania i fotosyntezy i dodaje się go zwykle jako siarczan manganu w stężeniach 5-30 µM.
Cynk
Cynk jest również wymagany do aktywności enzymatycznej. Dodawany do podłoża w stężeniach podobnych do manganu. Najbardziej rozpowszechnioną formą, w której cynk jest dodawany to siarczan.
Bor
Bor jest niezbędnym elementem zaangażowanym w biosyntezę ligniny i w metabolizm kwasów fenolowych. Dostarczany w postaci kwasu borowego w stężeniach 25-100 µM. Objawy niedoboru charakteryzują się martwicą wierzchołka pędu.
Miedź
Miedź jest istotna w wielu reakcjach enzymatycznych, w tym w cyklu oksydazy cytochromowej. Dodawana w postaci siarczanu magnezu, w bardzo niskich stężeniach (0,1 µM). Przy wysokiej koncentracji może być toksyczna.
Molibden
Molibden bierze udział w transformacji azotanu do amonu. Pożywka suplementowana 1 µM molibdenianu sodu.
Kobalt
Kobalt nie jest uważany jako istotny składnik w fizjologii roślin, ale jest zawarty w wielu powszechnie stosowanych podłożach hodowlanych. Jest dostarczany w niskich stężeniach, ponieważ tak samo jak miedź w wyższych może być toksyczny.
Mimo, iż stwierdzono, że również jod nie jest ważnym elementem to dodaje się go do pożywek (5 µM), ponieważ zauważono jego wpływ na poprawę wzrostu korzeni i kalusa w in vitro.
Inne elementy: nikiel, glin, krzem są dodawane do nielicznych pożywek. Nie zostały one uznane za istotne dla większości gatunków.
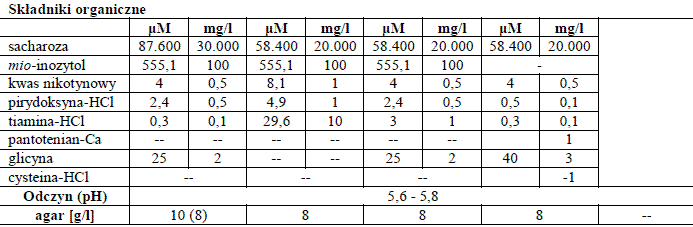
Składniki organiczne w pożywkach do prowadzenia kultur in vitro
Związki organiczne są również dodawane do pożywek roślinnych. Niektóre z tych związków, takich jak cukry, są absolutnie niezbędne dla wzrostu, podczas gdy inne, takie jak witaminy czy kwasy organiczne, nie muszą stanowić istoty pożywki, ale mogą przyspieszyć wzrost.
Aminokwasy są powszechnie dodawane do pożywek. Do tych najczęściej stosowanych można zaliczyć glicynę, inne to: kwas asparaginowy, arginina, asparagina, alanina, kwas glutaminowy, glutamina i prolina, ale w większości przypadków ich dodatek nie jest konieczny. Aminokwasy stanowią dobre źródło zredukowanych jonów azotu. Hydrolizat kazeiny może stanowić relatywnie tanie źródło mieszanki aminokwasów.
Źródło węgla
Zwykle kultury tkankowe roślin nie są wysoce autotroficzne, ze względu na ograniczenia w dostępności CO2. Dlatego cukier jest dodawany do medium jako źródło energii. Sacharoza jest tania, łatwo dostępna, dobrze przyswajalna i stosunkowo stabilna. Na drodze metabolizmu rozkładana jest do glukozy i fruktozy. Jest również częściowo hydrolizowana podczas autoklawowania. Koncentracja cukrów w pożywce wynosi zwykle od 20 do 40 g/l. Inne węglowodany (takie jak: glukoza, maltoza, fruktoza, galaktoza czy sorbitol) mogą być również używane. Okazuję się, że w niektórych przypadkach są o wiele bardziej skuteczne niż sacharoza. Cukry odgrywają również rolę osmotyczną. Potencjał ten może mieć istotny wpływ na odpowiedź w in vitro. Sole mineralne biorą udział w regulacji potencjału wodnego w 20-50%, a resztę funkcji pełnią właśnie węglowodany. Kiedy sacharoza ulegnie hydrolizie podczas autoklawowania, jej wkład w potencjał osmotyczny jest tym większa.
Witaminy
Jedynie tiamina (witamina B1), która jest niezbędna do metabolizmu węglowodanów i biosyntezy niektórych aminokwasów, okazała się mieć zasadnicze znaczenie dla większości kultur roślinnych. Kwas nikotynowy (niacyna) i pirydoksyna (B6) są powszechnie dodawane do medium Murashige i Skoog i niektórych innych. Inne witaminy, takie jak biotyna, kwas foliowy, kwas askorbinowy (witamina C) i witamina E (tokoferol) dodaje się rzadko. Stężenia witamin są zazwyczaj bardzo niskie.
Mio-inozytol – alkohol cukrowy, dodawany do większości podłoży hodowlanych. Szczególnie u jednoliściennych znacznie poprawia odpowiedź w kulturze.
Węgiel aktywowany
Jest czasem dodawany do mediów w celu adsorpcji związków toksycznych wydalanych przez tkanki roślinne, zwłaszcza utlenione naturalne fenole. Może to być szczególnie ważne w pożywkach ukorzeniających. Jednak węgiel aktywowany adsorbuje nie tylko toksyczne związki, ale także regulatory wzrostu i inne związki, które są dodawane do medium.
Związki żelujące
Stosowane w celu przygotowania stałych i półstałych pożywek. Wybór środka żelującego dla poszczególnych roślin jest na ogól empiryczny. Z nieznanych powodów, tkanki niektórych gatunków nie rosną jednakowo w obecności każdego czynnika żelującego.
Agar, produkowany z krasnorostów, jest najpopularniejszym typem środka żelującego i nadający się do codziennych zastosowań. Zbudowany jest z w dwóch komponentów: agarozy i agaropektyny. Gdy agar miesza się z cieczą, tworzy żel, który topi się w temperaturze ok. 100°C i krzepnie w temperaturze około 45°C. Zaletą jest to, że agar nie reaguje ze składnikami pożywki i nie jest trawiony przez enzymy tkanek roślinnych. Jako, że jest to produkt naturalny czasem jego jakość może różnić się od dostawcy i partii. Nie wpływa to znacząco na odpowiedź kultury. Są jednak doświadczenia, gdzie czasami agar nie jest najlepszym rozwiązaniem. Agar nie działa dobrze w środowisku kwaśnym (pH<4,5). Dodatek węgla aktywnego również może wpłynąć na proces żelowania. Stężenie agaru powszechnie stosowane w podłożach hodowlanych roślin to 0,5-1%. Zbyt płynna pożywka może powodować szklistość tkanek, a zbyt twarda ograniczenie wzrostu. Jest wiele alternatyw dla tej substancji o jakości o wiele lepszej. Są to np. agaroza lub gumy gellan.
Agaroza jest stosowana, gdy wymagana jest wyższa czystość podłoża. Przykładem są kultury protoplastów, gdzie zanieczyszczenia agaru są niepożądane. Pozyskiwana z agaru i jest znacznie droższa od niego. Główną zaletą jest fakt, że powoduje wyższą wytrzymałość żelu, a przy tym można wykorzystać mniejsze stężenia tej substancji.
Gumy gellan to rozpuszczalne w wodzie polisacharydy produkowane przez Pseudomonas elodea. Są komercyjnie dostępne pod marką AppliedGel, Phytagel lub Gelrite. Zaletą mediów zestalonych tymi substancjami jest to, że można wykryć zakażenia w bardzo wczesnym stadium. Zanieczyszczenia zawarte w Gerlite to nieorganiczne jony, brak jest związków organicznych. Jednym z ograniczeń Gelrite jest to, że stężenie kationów dwuwartościowych, takich jak jony wapnia i magnezu musi mieścić się w zakresie 4-8 mM / litr.
Phytagel ™ jest ekonomiczną alternatywą agaru, dający klarowny, bezbarwny żel o wysokiej wytrzymałości, który pomaga w wykryciu zakażenia bakteryjnego. Jest on używany w stężeniu 1,5-2,5 g/l.
Te czynniki żelujące są w stanie wytrzymać nawet temperaturę 120°C. Wykorzystywane są nie tylko w kulturach in vitro roślin, ale i w mikrobiologii np. przy hodowli mikroorganizmów termofilnych. Ponadto można suplementować pożywki takimi związkami jak: mleczko kokosowe, woda kokosowa, ekstrakt drożdżowy, soki czy pulpy owocowe. Mogą one dostarczać aminokwasy, witaminy, regulatory wzrostu roślin, i / lub metabolity wtórne roślin. Były one jednak powszechnie stosowane w czasach, gdy techniki kultur in vitro „raczkowały”, a składniki potrzebne do wzrostu rośliny były słabo zdefiniowane.
Wyżej wymienione składniki pożywek stanowią niezbędne elementy dla komórek roślinnych. Inne dodatkowe związki wprowadzane są w celu manipulacji wzrostu i rozwoju rośliny. Są to np. fitohormony i inne regulatory wzrostu (auksyny, gibereliny, cytokininy, kwas abscysynowy i etylen).
Tabela 1. Składniki przykładowych pożywek.
Zastosowanie kultur in vitro
Kiedy wspomina się o kulturach in vitro roślin, wielu osobom kojarzy się to z hodowlą roślin w doniczkach, szklanych naczyniach, fitotronach czy polu. Dawniej, techniki kultur tkankowych były przede wszystkim wykorzystywane w badaniach akademickich nad totipotencją (totipotencjalność, ekwipotencjalność rozwojowa), rolą fitohormonów w cytodyferencjacji i organogenezie. Obecnie, mamy możliwość wglądu w biologię molekularną roślin i regulację genów.
Metody kultur in vitro ze względu na ich niski koszt odgrywają kluczową rolę w wielu dyscyplinach nauk przyrodniczych, m.in. w rolnictwie, w rolnictwie tropikalnym, ogrodnictwie, leśnictwie, hodowli i biotechnologii roślin.
Wraz z rozwojem biotechnologii wiedza z zakresu kultur in vitro, w której mamy do czynienia z roślinami lub ich fragmentami w postaci organów, tkanek, komórek, organelli czy substancji chemicznych czy też z hodowlami komórek zwierzęcych, wydaje się niezbędna. Kultury roślinne in vitro mają szerokie zastosowanie m.in. w produkcji nowych odmian roślin w wyniku wprowadzenia obcego DNA do genomu komórki roślinnej, w hodowli roślin pozbawionych patogenów dzięki zastosowaniu kultur merystemów, w hodowlach bioreaktorowych do produkcji białek, antygenów i przeciwciał, w pozyskiwaniu farmakologicznie czynnych metabolitów wtórnych. Pozwalają na produkcję odmian rzadkich, ginących lub chronionych itp. Rośliny takie można dzięki rozmnażaniu in vitro przywrócić do naturalnego środowiska. Można uzyskać klony roślin o pożądanych i wyselekcjonowanych cechach, na przykład drzew o zwiększonej odporności na warunki stresowe lub patogeny. Kultury in vitro sprzyjają szybkiemu i masowemu rozmnażaniu cennych gatunków i genotypów (np. u goździków z jednego merystemu można uzyskać 10 milionów sadzonek). Obecnie na świecie za pomocą kultur in vitro produkuje się 800 milionów sztuk roślin rocznie, z czego 90% to gatunki ozdobne. Przełamywanie barier niekrzyżowalności oraz hodowla mieszańców heterozygotycznych jest również możliwa. Produkcji sztucznych nasion. Składają się one z somatycznego zarodka i syntetycznej osłony spełniającej funkcje ochronno-odżywczą. Techniki in vitro można zastosować w celu przerwania spoczynku nasion, a także przy produkcji haploidów i podwojonych haploidów. Ponadto rozwój tej dziedziny biotechnologii jest nieprzerwany. Poszukuje się najbardziej optymalnych warunków prowadzenia kultur, w celu poszerzenia spektrum badanych gatunków.
Autor: Joanna Chojak

