PRZEDRUK, oryginał dostępny pod adresem www
Tytuł oryginalny: Wykrywanie obecności enzymów
Politechnika Śląska (www)
Wydział Chemiczny (www)
Katedra Chemii Organicznej, Bioorganicznej i Biotechnologii (www)
Kierownik Katedry: dr hab. inż. Mirosław Gibas prof. Politechniki Śląskiej
Adres:
ul. B. Krzywoustego 4
44-100 Gliwice
Oksydoreduktazy katalizują wiele istotnych reakcji komórkowych zwłaszcza dotyczących utleniania biologicznego, które polega na łączeniu się wodoru z tlenem. W komórkach utlenia się jednak nie wodór cząsteczkowy, ale związany przeważnie z koenzymami nikotynamidoadeninowymi, które go pobierają wprost od substratów biologicznych utleniań (glukozy, kwasów tłuszczowych, aminokwasów itp.). Biologiczne utlenianie wodoru polega na przeniesieniu elektronów nie wprost z wodoru na tlen, ale przez wiele biologicznych układów oksydoredukcyjnych. Przyjmując za kryterium mechanizm działania, enzymy klasy oksydoreduktaz można ująć w cztery grupy:
– oksydazy,
– oksygenazy,
– dehydrogenazy,
– hydroperoksydazy.
Oksydazy aktywują atomy tlenu do przyjęcia elektronów oderwanych od utlenianego substratu i katalizują połączenie powstałych jonów tlenkowych z protonami na cząsteczkę H2O lub H2O2. Enzymy te przenoszą wodór bezpośrednio na tlen atmosferyczny. Substratem są często mono- i polifenole. Duże znaczenie praktyczne ma oksydoreduktaza o-difenol:tlen (EC.1.10.3.1.) zwana potocznie oksydazą fenolową. Typową reakcją katalizowaną przez ten enzym jest utlenianie pirokatechiny. Działaniu enzymu ulega również fenol jednowodorotlenowy, przy czym najpierw tworzy się pirokatechina. Oksydaza fenolowa jest metaloproteiną i zawiera miedź, która przyjmuje elektrony od dwufenoli i przekazuje na tlen cząsteczkowy.
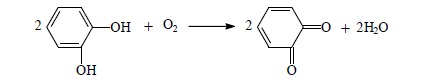
Oksydaza ksantynowa katalizuje utlenianie ksantyny tlenem powietrza. W wyniku reakcji powstaje kwas moczowy i nadtlenek wodoru. Enzym ten katalizuje też utlenianie aldehydów do kwasów organicznych. Reakcja zachodzi także w obecności innych niż tlen akceptorów wodoru. Jeżeli jako akceptora wodoru użyje się błękitu metylenowego, to barwa niebieska zanika, gdyż błękit metylenowy redukuje się do bieli błekitu.
Oksygenazy katalizują proces wbudowywania O2 w czasteczkę. Wyróżnia się oksygenazy właściwe i hydroksylujące.
Dehydrogenazy katalizują odrywanie atomów wodoru od utlenianego substratu i przenoszą je na inne enzymy czy związki pośrednie, a nie maja zdolności przenoszenia elektronów bezpośrednio na tlen. Różnią się one rodzajem koenzymów, które są właściwymi chwytnikami atomów wodoru.
Hydroperoksydazy obejmują dwie podgrupy enzymów, tj. peroksydazy (przeważają w tkankach roślinnych) i katalazy (w tkankach zwierzęcych).
Reprezentują one białka zawierające żelazoporfirynę. Reakcje katalizowane przez hydroksydazy przedstawia schemat:
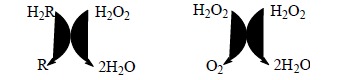
Peroksydaza jest enzymem bardzo rozpowszechnionym w roślinach. Jej działanie związane jest z obecnością nadtlenku wodoru. Nadtlenek wodoru nie jest rozkładany z wydzieleniem tlenu, lecz wykorzystywany przez enzym w reakcjach utleniania substratów (np. fenoli):
H2O2 + fenole 2H2O + chinony
Peroksydaza jest mało wrażliwa na wysoką temperaturę i jeszcze w 100OC częściowo zachowuje swoją aktywność. Oksydazy o wiele szybciej niż peroksydazy tracą swoją aktywność w podwyższonej temperaturze.
Katalazy obecne we wszystkich organizmach tlenowych, katalizują rozpad H2O2 według równania:
2H2O2 2H2O + O2
Katalazy charakteryzują się dużą aktywnością. Inhibitorami katalazy są między innymi jony CN– i S-2.
Zobacz też: Wykrywanie obecności enzymów

