Autor: Anna Kurcek
Wektorami nazywa się organizmy lub cząsteczki zdolne do przenoszenia materiału biologicznego (głównie DNA) z ustroju dawcy do ustroju biorcy. Są one powszechnie stosowane w biotechnologii jako narzędzie inżynierii genetycznej.
Wyróżnia się:
• wektory ekspresyjne – warunkują ekspresję wprowadzanych genów lub ich integrację z materiałem genetycznym biorcy;
• wektory klonujące – zawierają charakterystyczny układ genów, umożliwiający polimerazie DNA rozpoczęcie replikacji; powodują klonowanie, czyli namnażanie w dużych ilościach wprowadzanego materiału genetycznego;
• wektory bifunkcjonalne (wahadłowe) – mogą egzystować w minimum dwóch różnych organizmach.
Wprowadzenie do komórki obcego materiału genetycznego nazywa się transformacją. Jej typ warunkowany jest rodzajem zastosowanego wektora.
Transformacja autonomiczna
Wprowadzony gen docelowy jest replikowany niezależnie od genomu biorcy. Możliwe jest to dzięki autonomicznie replikującym się sekwencjom ori (bakterie) lub ARS (S. cerevisiae).
Rodzaje wektorów:
• wektory plazmidowe,
czyli pozachromosomowe fragmenty DNA. Są to głównie cząsteczki koliste, które mogą zawierać w swojej budowie jedynie niewielkie fragmenty naturalnie występujących plazmidów bakteryjnych. Najwcześniej poznany typ plazmidu – ColE1 pochodzący z E. coli, stał się pierwowzorem dla powszechnie używanych pBR322 i serii pUC.
• sztuczne chromosomy,
które w odróżnieniu od naturalnych chromosomów metafazowych nie zawierają komponentów białkowych, lecz jedynie czysty DNA, który po wprowadzeniu do komórki łączy się z białkami jądrowymi.
o YAC – sztuczny chromosom drożdżowy (ang. yeast artifical chromosome)
Liniowy konstrukt o dużej pojemności (nawet do miliona par zasad). Po raz pierwszy został skonstruowany w 1983 roku przez Andrew W. Murraya i Jacka W. Szostaka. Ustalone przez nich zasady są do dziś aktualne. Do swoich badań wykorzystali oni niekodujące chromosomowe DNA drożdży – sekwencje telomerowe gwarantujące stabilność, centromerowe odpowiedzialne za prawidłową segregację oraz autonomicznie replikujące się sekwencje (ARS), między którymi umieszczali przeznaczone do klonowania fragmenty. Ten typ wektora posłużył do zsekwencjonowania pierwszego genom organizmu wielokomórkowego – Caenorhabditis elegans i pierwszej rośliny uprawnej – ryżu. Wykorzystany jest on również jako nośnik w transformacji genetycznej roślin oraz zwierząt.
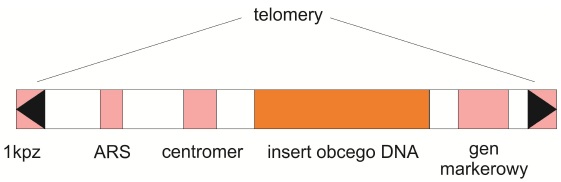
Rys. 1. Schemat budowy sztucznego chromosomu drożdżowego (YAC)
o BAC – sztuczny chromosom bakteryjny (ang. bacterial artificial chromosome)
To typowy wektor molekularny, który zawiera jedynie fragmenty bakteryjnego chromosomu – kolista cząsteczka pozbawiona sekwencji telomerowych, centromerowych oraz ARS. Zawiera DNA bakteryjnego czynnika F, warunkującego replikację całego konstruktu w komórkach E. coli. Pozwala klonować odcinki DNA o wielkości kilkuset tysięcy par zasad. Stosowany przy mapowaniu i sekwencjonowaniu genów eukariotycznych. Z jego pomocą skompletowano m.in. mapy fizyczne chromosomów Drosopchila melanogaster. W formie liniowej może również służyć jako nośnik do integracyjnej transformacji genetycznej zwierząt.
o MAC – sztuczny ssaczy chromosom (ang. mammalian artificial chromosome)
W swojej budowie zawiera on zarówno sekwencje telomerowe, jak i centromerowe. Posiada również zdolność do replikacji. Można go konstruować z wybranych odcinków DNA (podobnie jak YAC) lub sztucznie skracać chromosomów do minimalnej wielkości, zachowującej właściwości typowego chromosomu mitotycznego.
o HAC – sztuczny ludzki chromosom (ang. human artificial chromosome)
o PAC (ang. P1 – derived artificial chromosome)
W swojej budowie jest podobny do BAC, jednak oprócz czynnika F zawiera również sekwencję ori pochodzącą z bakteriofaga P1.
Transformacja integracyjna
Dzięki komórkowym mechanizmom naprawczym gen dawcy jest na trwałe wbudowywany w genom biorcy.
Rodzaje wektorów:
• wektory wirusowe (fagowe) – wykorzystują naturalne właściwości wirusów do wbudowywania swojego materiału genetycznego w genom zainfekowanej komórki. Przed zastosowaniem tego wektora, należy go najpierw pozbawić infekcyjnosci. Cechuje się małą pojemnością, za to wprowadzony z jego pomocą gen może ulegać ekspresji przez dłuższy okres czasu. Największe perspektywy ma zastosowanie lentiwirusów, czyli retrowirusów, których materiał genetyczny jest zawarty w kwasie rybonukleinowym (RNA).
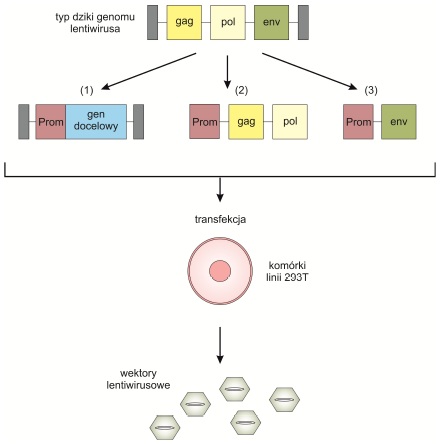
Rys. 2. Produkcja wektorów lentiwirusowych
Typ dziki genomu lentiwirusa składa się z trzech głównych genów (gag, pol, and env), otoczonych długimi, powtarzalnymi sekwencjami terminalnymi. Zostaje on podzielony na trzy rodzaje plazmidów zawierających: gen docelowy (1) , sekwencje regulatorowe – niezbędne do namnożenia materiału genetycznego oraz elementów strukturalnych wirusa (2) oraz geny kodujące białka kapsydu (3). Za ich pomocą przeprowadza się transformację komórek z linii 293T, która w efekcie produkuje wektory lentiwirusowe.
• wektory bakteryjne – wykorzystuje się naturalne patogeny roślin wyższych. Ten sposób transformacji, nazywa się agroinfekcją, lub inaczej agrotransformacją. Bakteria Agrobacterium tumefaciens jest naturalnym patogenem roślin dwuliściennych. Zawiera ona plazmid Ti (ang. tumor- inducing), którego fragment T-DNA (ang. transferred DNA) może łączyć się na trwałe z genomem gospodarza i ulegać ekspresji warunkując niekontrolowane podziały komórkowe. W genetycznej transformacji roślin stosuje się całe komórki bakteryjne wraz z plazmidem Ti pozbawionym T-DNA i zaopatrzonym w geny docelowe. Zakaża się nimi zranione rośliny lub kultury tkankowe. Stransformowaną komórkę przekształca się następnie w komórkę o właściwościach zygoty, tzn. zdolną do różnicowania się i szybkich podziałów.
Stosuje się również bakterie Agrobacterium rhizogenes zawierającą plazmid Ri (ang. root – inducing) oraz Rhizobium, Sinorhizobium, Mezorhizobium pobierające zmodyfikowany plazmid Ti.
Dzięki tej metodzie uzyskano pierwsze rośliny transgeniczne.
Również sam plazmid może spełniać funkcje wektora. Jest to tzw. transformacja bezpośrednia (ang. direct gene transfer), która pozwala obejść się bez pośrednictwa Agrobacterium tumefaciens. Komórkę roślinną trzeba jednak przedtem pozbawić ściany komórkowej. Takie wektory – nie posiadające zdolności wnikania do komórek biorcy nazywa się konstruktami. W swojej budowie zawierają one obok genów docelowych również sekwencje pomocnicze:
• reporterowe – kodujące produkty łatwe do wykrycia metodami biochemicznymi (cat), cytochemicznymi (gus, lacZ) lub umożliwiającymi obserwację bez konieczności niszczenia badanej tkanki (gfp, luc);
• markerowe – nadają cechę odporności na wybrany czynnik presji selekcyjnej, np. herbicyd (epsps, Ph – odporność na glifosat), antybiotyk (aadA, Sf – odporność na streptomycynę). Gen markerowy bar warunkuje odporność na herbicydy fosofotricynowe i jest często wykorzystywany jako gen docelowy;
• sekwencje regulacyjne z najważniejszą sekwencją promotorową.
Do organizmu biorcy można również wprowadzać dodatkowe kopie genu rodzimego, np. genu transformacji antysensownej.
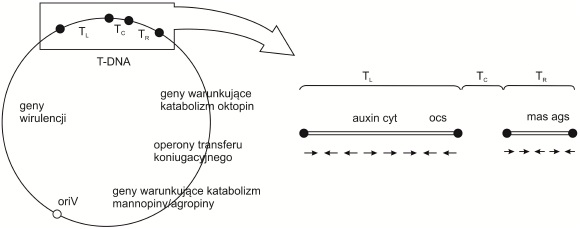
Rys. 3. Schemat budowy oktopinowego plazmidu Ti
T-DNA jest podzielony na trzy regiony: TL (ang. T-DNA left), TC (ang. T-DNA center), TR (ang. T-DNA right).
Czarne punkty wskazują na sekwencje powtarzalne; biały punkt oznacza oriV – miejsce startu replikacji plazmidu; strzałki wskazują kierunek transkrypcji genów odpowiedzialnych za syntezę auksyn (auxin), cytokinin (cyt) oraz Opin: oktopiny (ocs), mannopiny (mas), agropiny (ags).
Aby transformacja bezpośrednia była możliwa należy przedtem zastosować zabiegi umożliwiające penetrację błony komórkowej:
o glikol polietylenowy (PEG)
Jest to czynnik rozluźniający strukturę błony komórkowej, stosowany przy transformacji drobnoustrojów i kultur komórek zwierzęcych. Umożliwia bierne pobieranie DNA przez komórki. Nie nadaje się jednak do transformacji komórek roślinnych posiadających ścianę komórkową.
o elektroporacja
W wyniku działania silnego impulsu elektrycznego, w błonie komórkowej tworzą się tymczasowe pory. Odgrywa ona ważną rolę w transformacji komórek zwierzęcych oraz drobnoustrojów. Wprowadzać można również geny do pozbawionych ściany komórek roślinnych pochodzących z tkanki bogatej w komórki totipotencjalne (merystemy, kwiatostany, zarodki, tarczki zarodkowe).
o biolistyka (mikrowstrzeliwanie, bombardowanie biolistyczne, metoda strzelby genowej),
Wprowadzany DNA opłaszcza się (poprzez krótkotrwałe wytrząsanie) na mikropocisku, który następnie wstrzeliwuje się do wybranego materiału biologicznego. Strzelba genowa nadaje cząsteczkom prędkość dzięki fali uderzeniowej helu z butli ze sprężonym gazem. Przygotowanie konstruktu zależy od specyfiki wybranego materiału. Jest to bardzo uniwersalna metoda. Za jej pomocą można wprowadzić dowolny obcy DNA do komórek dowolnego biorcy. Nie wymaga stosowania niebezpiecznych dla zdrowia odczynników, ani preparowania protoplastów. Powoduje jednak stres abiotyczny, czyli liczne mechaniczne uszkodzenia żywotność bombardowanych komórek i tkanek. Wprowadza również do komórki obcy materiał nośnikowy – wolfram, lub bardziej bierne chemicznie – złoto.
o mikroiniekcja, mikrowstrzykiwanie
Obce geny wstrzykuje się pod mikroskopem za pomocą ultracienkiej mikropipety. Jest to powszechnie stosowana metoda wprowadzania obcego DNA do komórek zwierzęcych – głównie jednokomórkowych zarodków, które następnie umieszcza się w macicy matki zastępczej. Może również służyć do wprowadzania sztucznych chromosomów (YAC, MAC i HAC).
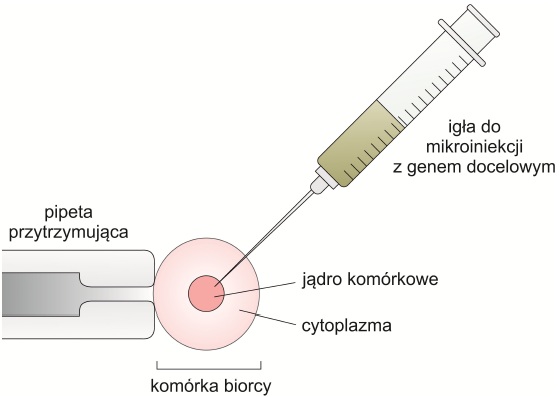
Rys. 4. Mikroiniekcja
Literatura:
• Jerzy Buchowicz “Biotechnologia molekularna – Modyfikacje genetyczne, postępy, problemy”, Wydawnictwo Naukowe PWN, Warszawa 2009;
• Frank Park “Lentiviral vectors: are they the future of animal transgenesis?”, Physiological Genomics 31:159-173 (2007);
• Aleksandar Perić “Wektory do terapii genowej”, Zakład Biofizyki Obliczeniowej i Bioinformatyki Wydział Biochemii, Biofizyki i Biotechnologii Uniwersytet Jagielloński 2011 (bioinfo.mol.uj.edu.pl/ articles/Peric04);
• Stanton B. Gelvin “Agrobacterium-Mediated Plant Transformation: the Biology behind the “Gene-Jockeying” Tool”, Microbiol Mol Biol Rev. 2003 March; 67(1): 16–37;
• Brenda Grimes* and Howard Cooke “Engineering Mammalian Chromosomes”; Human Molecular Genetics, 1998, Vol. 7, No. 10 Review 1635–1640.

