Insulina jest to hormon wytwarzany przez trzustkę w celu regulacji ilości glukozy we krwi. Jej nazwa oznacza z łac. insula – wyspa i pochodzi od wysepek Langerhansa trzustki, jako dokładnego miejsca jej produkowania. Została odkryta przez Fredeicka Bantinga i jego asystenta Charlesa Besta w 1922 roku. Za to odkrycie Banting został wyróżniony rok później Nagrodą Nobla. Kolejne lata przyniosły nowe osiągnięcia w tej dziedzinie: w 1934 roku zastosowano cynk do krystalizacji insuliny, dwa lata później uzyskano insulinę protaminową, w roku 1970 zastosowano po raz pierwszy technologię uzyskiwania insuliny wysoko oczyszczonej, a od 1985 zaczęto wytwarzać insulinę ludzką.
Insulina jest białkiem o masie cząsteczkowej ok. 6000 Da, zbudowanym z 51 aminokwasów, zgrupowanych w 2 łańcuchy (A i B), a połączonych dwoma mostkami siarczkowymi.
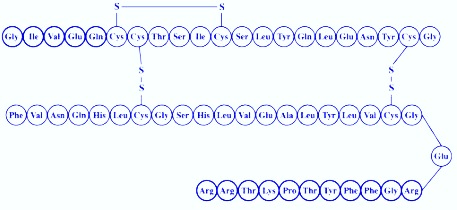
Rys 1. Budowa monomeru insuliny.
U osób z cukrzycą trzustka nie wytwarza insuliny wcale lub wytwarza jej niedostateczną ilość albo też nie jest w stanie efektywnie wykorzystać insuliny, którą wytwarza. Jako wynik tego, w krwiobiegu gromadzi się glukoza, co może prowadzić do poważnych problemów zdrowotnych, tj. choroby serca, uszkodzenia nerwów, zaburzenia pracy nerek czy erekcji.
Typy cukrzycy:
• typ 1 (insulinozależny) – jest schorzeniem na tle immunologicznym, u osób chorych dochodzi do autoagresji, w wyniku czego uszkodzeniu ulegają komórki β wysp trzustkowych. Deficyt insuliny objawia się hiperglikemią i cukromoczem. Brak leczenia może prowadzić do kwasicy ketonowej, a nawet śpiączki. Niedobory insuliny muszą być uzupełniane poprzez codzienne przyjmowanie preparatów insulinowych.
• typ 2 (insulinoniezależny) – stanowi ponad 90% wszystkich zachorowań, jest warunkowany dziedzicznie, choć wpływ na jego występowanie mogą też mieć czynniki środowiskowe. Cechą tej postaci jest insulinooporność, co wiąże się z zachowanym, choć zaburzonym wydzielaniem insuliny endogennej. Osoby z tym rodzajem cukrzycy są w stanie utrzymywać glukozę na odpowiednim poziomie we krwi poprzez odpowiednie odżywianie, aktywność fizyczną oraz przyjmowanie leków przeciwcukrzycowych.
• cukrzyca ciężarnych – występuje u 2-5% ciężarnych, powstaje w czasie ciąży pod wpływem metabolicznych i hormonalnych zmian w organizmie matki. Mija po porodzie, ale zwiększa prawdopodobieństwo wystąpienia w późniejszym okresie cukrzycy typu 2.
• cukrzyca wtórna – jest wynikiem wystąpienia innych schorzeń pierwotnych, np. chorób gruczołów wydzielania wewnętrznego przebiegających z nadczynnością – nadmierne wydzielanie hormonu wzrostu, kortyzolu czy glukagonu. Może powstać też po usunięciu trzustki lub przy stosowaniu niektórych leków, np. Encortonu.
Inżynieria insuliny
Cząsteczki naturalnej insuliny ulegają asocjacji, tworząc dimery, a następnie heksamery. Po podaniu (podskórnym lub domięśniowym) tworzą się złogi insuliny, z których muszą oddysocjować pojedyncze cząsteczki, by mogły przeniknąć do układu krążenia. Maksymalne stężenie insuliny stwierdza się więc 90-120 min. po iniekcji, co wymaga podawania preparatów na ok. godzinę przed posiłkiem. W konsekwencji pacjenci musza zachować odpowiedni reżim czasu posiłków. Za asocjację cząsteczek insuliny odpowiada głównie C końcowy fragment łańcucha B. Modyfikacje aminokwasów w tym obszarze mogą wpływać na zdolność cząsteczek do łączenia. Tak przekształcona insulina może być podana bezpośrednio przed posiłkiem. Przykładami są: Humalog– gdzie prolina i lizyna w pozycjach 28 i 29 łańcucha B zostały zamienione, czy też Leprolog, w którym prolina uległa wymianie na kwas asparaginowy. Z kolei preparat Lantus jest przykładem insuliny długo działającej. Tutaj glicyna w pozycji 21 łańcucha A zastępuje asparaginę, dodatkowo przyłączone są dwie cząsteczki argininy do C końca łańcucha B. Takie modyfikacje wpływają na przesunięcie punktu izoelektrycznego cząstki w kierunku obojętnych, insulina staje się słabiej rozpuszczalna w fizjologicznym pH, a produkt po podaniu tworzy w miejscu iniekcji mikrozłogi, z których następuje powolne uwalnianie monomerów insuliny.
Preparaty insulinowe
Poprzez dodatek do preparatów insulinowych substancji tj. protaminy – białka z nasienia ryb oraz cynku możliwe jest przedłużenie procesu wchłaniania tego leku z tkanki podskórnej. Uzyskujemy w ten sposób insuliny izofanowe, protaminowo-cynkowe oraz cynkowe. Tempo wchłaniania preparatu wpływa na szybkość i czas maksymalnego działania. Wydłuża się wówczas całkowity okres aktywności podanego leku. Ze względu na czas działania wyróżniamy więc następujące grupy:
1. insuliny krótkodziałające, krystaliczne, obojętne: Insulinom Neutralis, Maxirapid, Gensulin R, Humulin R, Actrapid. Ich cechą jest niska zawartość cynku, szybki początek działania – ok. 30 min. po podaniu i działanie przez 7-8 godzin. Oddzielną podgrupą są tu dwa analogi insuliny ludzkiej: lispro (Humalog) i aspart (NovoRapid), które działają już po 15 min. i dlatego nazywa się je szybko działającymi. Całkowity czas ich działania to 3-5 godzin.
2. insuliny o przedłużonym działaniu:
– o długim okresie działania (cynkowe), otrzymywane są z trzustek bydlęcych i nie mają zastosowania w monoterapii. Zaczynają działać po 3-4 godzinach od podania, a utrzymują się we krwi od 24-36 godzin. Należą tu: Humulin U czy Insulinom ultralente WO-S.
– o średnio długim okresie działania: izofanowe (Humulin N, Gensulin N, Insulatard HM) i dwufazowe. Działanie początkowe rozpoczyna się po 30min. do 2h., a całkowite trwa 18-24h. Ta grupa jest najbardziej popularna w leczeniu, nie tylko ze względu na czas stosowania, ale też możliwość łączenia insulin krótko- i długodziałającej.
Ze względu na pochodzenie insuliny dzielimy na:
1. zwierzęca – wytwarzana z trzustek bydła lub świń. Po procesie ekstrakcji uzyskuje się insulinę wołową lub wieprzową. Insulina wieprzowa różni się od ludzkiej jednym aminokwasem, zaś wołowa – trzema. Wpływa to na szybkość jej wchłaniania i rozpoczęcia czasu działania. Poza tym insulina wołowa może wywoływać odczyny alergiczne i zwiększać syntezę przeciwciał przeciwinsulinowych. Aby zaspokoić potrzeby insulinowe jednego pacjenta w ciągu roku potrzeba aż 7 kilogramów trzustki zwierzęcej. Produkcja tego rodzaju insuliny jest więc bardzo kosztowna.
2. ludzka – wytwarzana od lat osiemdziesiątych dzięki osiągnięciom metod inżynierii genetycznej, z zastosowaniem bakterii E.coli i drożdży piekarskich. W warunkach laboratoryjnych do komórek bakterii lub drożdży wprowadza się wyizolowany wcześniej ludzki gen odpowiedzialny za wytwarzanie insuliny. Mikroorganizmy zaczynają wytwarzać oprócz własnych białek, także insulinę ludzką, która jest stosowana z powodzeniem w leczeniu cukrzycy.
Ze względu na stopień oczyszczenia leku dzielimy je na:
1. insuliny zwierzęce o konwencjonalnym stopniu oczyszczenia (bez chromatografii)
2. insuliny zwierzęce oczyszczone techniką jednostopniowej chromatografii żelowej (ChO lub MP – insulina jednoszczytowa) – uzyskuje się w ten sposób 15 razy mniej proinsulin mogących wywołać odczyn immunologiczny oraz całkowite usunięcie z preparatu zanieczyszczeń białkowych
3. insuliny zwierzęce wysoko oczyszczone (oznaczane jako WO lub MC) – również z zastosowaniem metod chromatograficznych, dzięki czemu preparat zawiera 150 razy mniej proinsulin
4. wysoko oczyszczone preparaty insuliny ludzkiej (HM)
Insulina oczyszczona wykazuje nikłe właściwości antygenowe, dlatego też tak ważny jest ten proces w trakcie uzyskiwania preparatów. Coraz szerzej wykorzystywana jest insulina ludzka i tendencją jest całkowite zastąpienie nią preparatów z trzustek zwierzęcych. Wówczas proces oczyszczania straci na znaczeniu.
Przyszłość insulin
Ilość osób stosujących terapie insuliną jest coraz większą, na całym świecie trwają badania nad nowymi postaciami leku, które mogłyby być bardziej skuteczne, prostsze i dostosowane do indywidualnych potrzeb pacjentów, z jednoczesnym obniżeniem działań ubocznych i zwiększeniu tolerancji. Pojawiają się próby wprowadzenia insulin o nowych drogach podania, np. insulina dopoliczkowa (Oralin), testowane są też insuliny doustne i w plastrach. Wiosną 2006 roku zarejestrowany został preparat Exubery – pierwszy inhalator pozwalający na podanie insuliny drogą wziewną. Stopień zadowolenia z korzystania z tego typu insuliny jest duży, potrzebne są jednak lata badań klinicznych oceniających, czy jest ona adekwatna oraz badań oceniających potencjalne efekty niepożądane związane z jej długotrwałym przyjmowaniem.
Autor: Karolina Podsiadły
Literatura:
1. Kieć-Kononowicz K.: Nowe leki otrzymywane przy udziale technologii rekombinowanego DNA. Biotechnologia. 2004, 3(66) 87-100
2. Pustkowski M.: Insulina i jej preparaty. Żyjmy dłużej. 1998, 7
3. Rzepa M.: Cukrzyca i wspomaganie jej leczenia środkami pochodzenia roślinnego. Akademia Medyczna im. Piastów Śląskich, Wrocław, sierpień 2008
4. Szymborska-Kajanek A., Wróbel M., Grzeszczak W., Strojek K.: Insulina wziewna – kolejny milowy krok w leczeniu cukrzycy? Polskie Archiwum Medycyny Wewnętrznej. 2007, 117 (9): 415-419
5. www.mojacukrzyca.org/ 8.06.2011

