Autor: Marek Kowalczyk
Opracowanie techniki PCR (Polymerase Chain Reaction – łańcuchowa reakcja polimerazy) w latach 80. zrewolucjonizowało biologię molekularną. Metoda wprowadzona przez Karry’ego Mullisa pozwalająca na powielenie (amplifikację) dowolnego fragmentu w genomie w przeciągu zaledwie 2-3 godzin, wciąż pozostaje standardem i podstawą wielu dalszych analiz molekularnych. W ciągu trzech dekad które minęły od wprowadzenia techniki, doczekała się ona wielu modyfikacji, które poprawiają zarówno jej czułość (nano PCR), specyficzność (nested PCR), pozwalają na analizę przyrostu produktów w czasie rzeczywistym (Real-Time PCR), czy też na jednoczesną amplifikację wielu fragmentów (multiplex PCR). Cechą wszystkich powyższych odmian techniki PCR jest to że reakcja przebiega cyklicznie w ściśle określonych etapach termicznych obejmujących denaturację podwójnej nici, hybrydyzację starterów oraz elongację. Wyjątkiem pod tym względem jest stosunkowo nowa technika pozwalająca na izotermiczną amplifikację materiału genetycznego LAMP – Loop Mediated Isothermal Amplification.
Zasada działania techniki
Technika amplifikacji izotermicznej została opracowana przez japoński zespół prowadzony przez Notomi. W związku z zaletami takimi jak szybkość i prostota reakcji, krótki czas analizy oraz możliwość monitorowania przebiegu analizy w czasie rzeczywistym metoda została szybko zaadoptowana do celów diagnostycznych efektem czego było powstanie wielu gotowych komercyjnych zestawów diagnostycznych. Mimo że LAMP jest techniką stosunkowo nową, to szybko zyskuje coraz większa popularność.
LAMP jest nowatorski nie tylko ze względu na izotermiczny przebieg reakcji, pierwsze różnice w stosunku do klasycznych metod pojawiają się już na etapie projektowania starterów. W przypadku LAMP wykorzystuje się od czterech do sześciu par starterów hybrydyzujących do sześciu lub ośmiu miejsc w analizowanej sekwencji. Firma Eiken Chemical Co., Ltd. – jednostka rozwijająca i popularyzująca technikę, zaproponowała oprogramowanie PrimerExplore (Ryc. 1), służące do projektowania starterów dla reakcji LAMP.
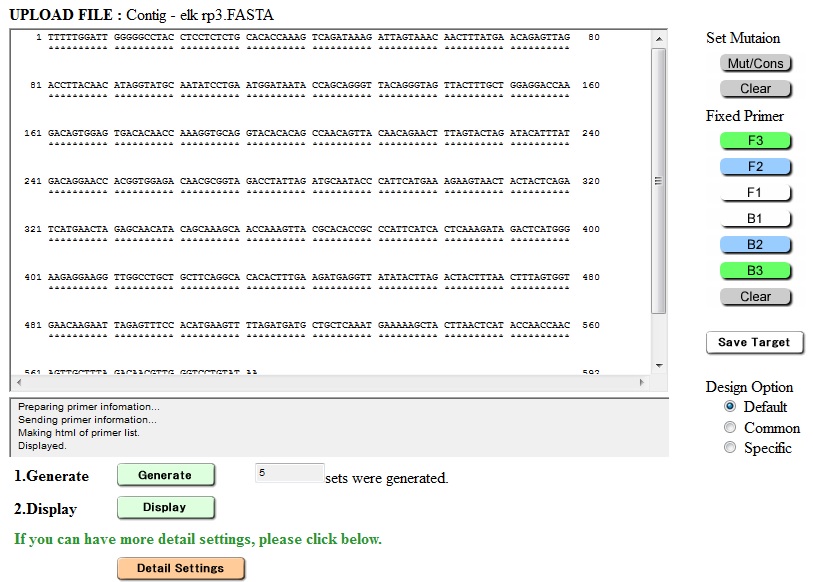
Ryc.1 Program do projektowania starterów o reakcji LAMP – PrimerExplorer (http://primerexplorer.jp/elamp4.0.0/index.html)
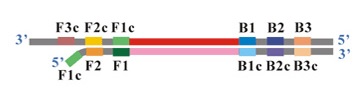
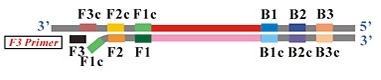
Do przeprowadzenia amplifikacji najczęściej wykorzystywana jest para starterów wewnętrznych (internal primers – FIP i BIP), para zewnętrzna (outer primers – F3 i B3), dodatkowo stosowana jest para tak zwanych loop primers. Startery zewnętrzne (F3 i B3) flankują regiony amplifikowane przez startery wewnętrzne. F3 i B3 są krótsze i występują w mieszaninie reakcyjnej w mniejszym stężeniu, tak aby wiązały się z matryca wolniej niż startery wewnętrzne (Ryc. 2) i inicjowały zastępowanie nici dupleksu przez nowo syntezowaną nić potomną. Startery zewnętrzne mają za zadanie przemieszczenie nici, startery wewnętrzne zawierające zarówno fragment komplementarny do nici sensownej jak i nonsensownej pozwalają na tworzenie pętli. Dodatkowo mogą być stosowane tak zwane startery zapętlające – loop primersC, które są komplementarne do regionów z uformowaną pętlą. Reakcja może przebiegać bez loop primers, jednak ich zastosowanie w istotnym stopniu zwiększa szybkość reakcji poprzez wiązanie się do fragmentów docelowej sekwencji nie objętych przez startery wewnętrzne, w ten sposób cała amplifikacja przebiega szybciej.
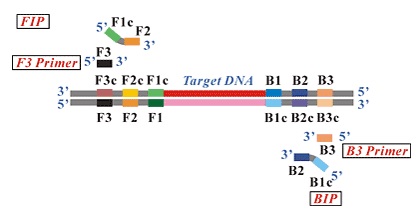
Ryc. 2 Układ amplifikacyjny reakcji LAMP (http://loopamp.eiken.co.jp/e/lamp/primer.html)
Cały proces jest możliwy dzięki wykorzystaniu specjalnej polimerazy Bst, izolowanej z Bacillus stearothermophilus. Główną właściwością enzymu jest jego aktywność pozwalająca na zastępowanie nici. Brak aktywności 3’-5’ egzonukleazy pozwala na uwalnianie nowo powstałych nici do mikstury reakcyjnej.
Mimo stosunkowo prostej procedury, reakcja ma złożony mechanizm. Proces ma charakter izotermiczny, przebiega zazwyczaj w temperaturze 65oC, tak więc w przeciwieństwie do klasycznego PCR pomijany jest etap denaturacji. Startery musza być zaprojektowane w ten sposób aby flankować regiony, które w tej temperaturze nie wykazują stabilnej formy dwuniciowej i okresowo przyjmują formę jednoniciową. W związku z faktem że cały proces przebiega w tej samej temperaturze nie jest konieczne posiadanie termocyklera a do przeprowadzenia analizy wystarcza zwykły blok grzejny, chociaż powstają również dedykowane do techniki urządzenia, które umożliwiają przeprowadzenie analizy nawet w warunkach poza laboratoryjnych (Ryc. 3).
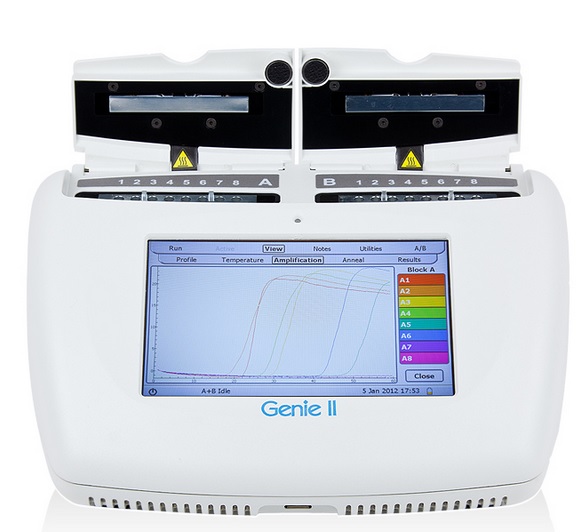
Ryc. 3 Aparat Genie II służący do amplifikacji izotermicznej (http://www.optigene.co.uk/instruments/instrument-genie-ii/)
Przebieg amplifikacji LAMP
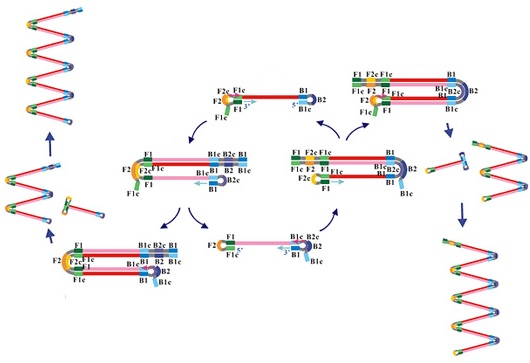
W pierwszym, tak zwanym niecyklicznym etapie starter wewnętrzny FIP hybrydyzuje do regionu F2c rozpoczyna syntezę nici potomnej komplementarnej do matrycy (Ryc. 4a).
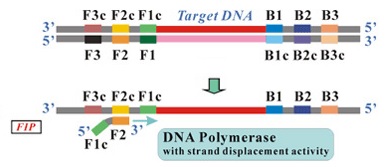
Ryc. 4a Przebieg amplifikacji LAMP – hybrydyzacja startera FIP i synteza nici potomnej (http://loopamp.eiken.co.jp/e/lamp/principle.html)
Następnie do nici matrycowej w obszarze regionu F3c wiąże się starter zewnętrzny F3 (Ryc. 4b), polimeraza Bst o aktywności zastępowania nici umożliwia syntezę nowej nici i jednoczesne uwolnienie nici powstałej przy udziale startera FIP do roztworu.
Ryc. 4b Przebieg amplifikacji LAMP – hybrydyzacja startera zewnętrznego F3 i synteza nici potomnej (http://loopamp.eiken.co.jp/e/lamp/principle.html)
W efekcie na tym etapie reakcji w roztworze pojawiają dwuniciowe cząsteczki jak i nici DNA z tendencją do formowania pętli na końcu 5’ (Ryc. 4c). Nić formuje pętle w związku z komplementarnością regionu F1c powstałego po dołączeniu startera z regionem F1 obecnym na matrycy.


Ryc. 4c Przebieg amplifikacji LAMP – układ powstały po pierwszej rundzie amplifikacji – cząsteczka dwuniciowa i uwolniona do roztworu nić potomna (http://loopamp.eiken.co.jp/e/lamp/principle
Pojedyncza nić dzięki odpowiedniej strukturze końca 5’ tworzy w tym obszarze pętle, natomiast region 3’ staje się obszarem do którego hybrydyzują startery B3 i BIP (Ryc. 4d)

Ryc. 4d Przebieg amplifikacji LAMP – formowanie pętli na końcu 3’ (http://loopamp.eiken.co.jp/e/lamp/principle.html)
Po hybrydyzacji starterów B3 i BIP, następuje amplifikacja w wyniku której oprócz struktur dwuniciowych powstają fragmenty jednoniciowe o strukturze hantli (Ryc. 4e).


Ryc. 4e Przebieg amplifikacji LAMP – powstawanie struktury hantli (http://loopamp.eiken.co.jp/e/lamp/principle.html)
Struktura hantli jest finalnym produktem etapu niecyklicznego i tym samym stanowi matrycę dla cyklicznej amplifikacji, która w kolejnym etapie jest przekształcana w formę spinki do włosów (stem loop). Starter wewnętrzny FIP hybrydyzuje do jednoniciowego fragmentu DNA, w obrębie pętli i tym samym powstają kolejne cząsteczki produktu reakcji. Amplifikacja przebiegająca z wykorzystaniem starterów wewnętrznych prowadzi do powstawania coraz bardziej złożonych struktur. Występują wśród nich struktury pośrednie z podwojoną sekwencją docelową, jak i produkty w formie spinki do włosów, które napędzają reakcję amplifikacji cyklicznej. Po dołączeniu starterów wewnętrznych BIP do struktur pośrednich, następuje ich amplifikacja i zwielokrotnienie sekwencji matrycowej a następnie przejście w etap elongacji (Ryc. 4f).
Ryc. 4f Przebieg amplifikacji LAMP – powstawanie struktury spinki do włosów i cykliczna amplifikacja (http://loopamp.eiken.co.jp/e/lamp/principle.html
W jego trakcie powstają coraz bardziej złożone struktury, zawierające sekwencję docelową. W ten sposób po procesie amplifikacji izotermicznej obecne są sekwencje DNA o zróżnicowanej długości i ze zróżnicowaną liczbą pętli (struktury z angielskiego nazywane cauliflower-like structures), jak i struktury spinki do włosów o różnej długości.
Obecność w mieszaninie reakcyjnej starterów zapętlających – loop, zwiększa wydajność amplifikacji, a tym samym skraca czas reakcji. Proces bez zastosowania starterów zapętlających trwa około 50 minut, po ich dodaniu czas trwania amplifikacji jest zredukowany do zaledwie 20 minut. Startery loop nie tylko przyspieszają reakcję, ale też zwiększają jej specyficzność (sekwencja na większej długości jest pokrywana przez startery). Aktywność starterów loop pojawia się po wytworzeniu struktury spinki do włosów, startery hybrydyzują do obszarów pętli, stanowiąc dodatkowe miejsca flankujące sekwencje docelową (Ryc. 4g).
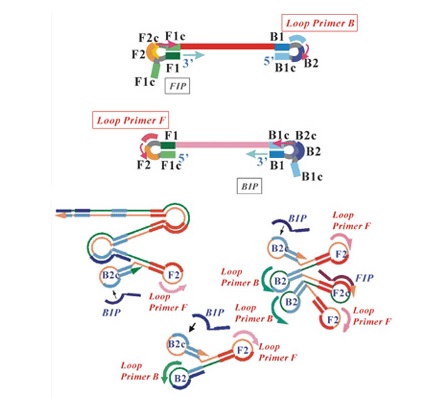
Ryc. 4g Przebieg amplifikacji LAMP – amplifikacja matryc o strukturze hantli przez startery typu loop (http://loopamp.eiken.co.jp/e/lamp/principle.html)
LAMP a PCR
Kluczową kwestią w technikach amplifikacji jest czułość i specyficzność. Porównanie metody LAMP i PCR wskazują że amplifikacja izotermiczna wykazuje czułość większą od łańcuchowej reakcji polimerazy o dwa rzędy wielkości. Zakres zastosowania LAMP został poszerzony poprzez połączenie metody z procesem odwrotnej transkrypcji (RT-LAMP -Reverse Transcription Loop-Mediated Isothermal Amplification) dzięki czemu możliwa jest detekcja wirusów RNA, z czułością większą niż w klasycznym RT-PCR. Również drugi parametr odgrywający kluczową rolę w diagnostyce – specyficzność jest wyższy w przypadku amplifikacji izotermicznej. Wynika to z większej liczby starterów – fragmentów wskazujących miejsce inicjacji reakcji, które muszą związać się specyficznie do większej liczby komplementarnych fragmentów w sekwencji docelowej. Jednak taka specyficzność ma swoją cenę, która jednocześnie wydaje się największą wadą LAMP, jest nią skomplikowana procedura projektowania starterów. Większa liczba oligonukleotydów zwiększa prawdopodobieństwo tworzenia struktur drugorzędowych oraz wymaga wyjątkowo starannego doboru sekwencji docelowej, dla której możliwe będzie zaprojektowanie optymalnych starterów. W przypadku projektowania starterów do LAMP, podobnie jak w klasycznym PCR należy wziąć pod uwagę kilka aspektów, jednym z nich jest odległość między regionami wiązania primerów, temperatura topnienia, skład nukleotydowy (zawartość par GC i AT) oraz tendencję do tworzenia struktur drugorzędowych. Odpowiednie ustalenie powyższych parametrów jest skomplikowane ze względu ma ilość starterów wykorzystywanych w reakcji, jednak etap projektowania jest kluczowy dla powodzenia całej reakcji.
Istotną wadą klasycznej amplifikacji metodą PCR, jest długotrwała procedura weryfikacji wyników, która polega na elektroforetycznym rozdziale analizowanych fragmentów. Wizualizacja DNA po elektroforezie jest możliwa dzięki zastosowaniu barwników interkalujących do DNA takich jak bromek etydyny i światła UV o odpowiedniej długości fali. Barwnik wbudowany w DNA absorbuje światło o danej długości fali, a następnie emituje promieniowanie o większej długości. Związki wbudowywane w podwójną helisę często mają charakter muta- i kancerogenny, pewną alternatywą są dostępne komercyjnie zamienniki takie jak Simple Safe, których szkodliwość jest mniejsza w stosunku do powszechnie stosowanego bromku etydyny.
W przypadku amplifikacji typu LAMP wizualizacja wyników, a nawet analiza samego przebiegu procesu jest możliwa w czasie rzeczywistym bez dodatkowych procedur. Przyrost produktu amplifikacji może być obserwowany jako postępujące zmętnienie, lub w przypadku wykorzystania odpowiednich barwników jako fluorescencja. Zmętnienie jest efektem reakcji jonów magnezowych z pirofosforanem (produktem ubocznym amplifikacji) w wyniku której powstaje nierozpuszczalny pirofosforan magnezu. Zmętnienie może być mierzone wzrokowo, lub z wykorzystaniem turbidymetrów. Ciekawą metodą detekcji jest zastosowanie fluoroforów takich ja kalceina, które wiążą jony metali. Dodatek do mieszaniny reakcyjnej jonów manganu i kalceiny nadaje pomarańczowe zabarwienie. W trakcie amplifikacji wydzielany jest pirofosforan, który wykazuje silniejsze powinowactwo do jonów manganu prowadząc do ich oddysocjowania od kalceiny i wyemitowania fluorescencji i zmiany zabarwienia na zielone, efekt jest wzmacniany po związaniu magnezu do fluoroforu. Powstający w trakcie reakcji pirofosoran manganu wytrąca się w postaci osadu, co również wskazuje na reakcje pozytywną.
W przypadku LAMP do detekcji produktów amplifikacji można także wykorzystać klasyczną elektroforezę w żelu agarozowym, jednak w przeciwieństwie do obrazu charakterystycznego dla reakcji PCR, wynikiem jest drabinka prążków rożnej długości. Powodem takiego wyniku jest amplifikacja matrycy pierwotnej do produktów o różnej strukturze i długości.
Zastosowania
LAMP ma przewagę nad klasycznym PCR zarówno w kwestii czasu trwania amplifikacji, jak i czułości detekcji specyficznego materiału w próbce, dlatego coraz powszechniej jest stosowany w gotowych zestawach diagnostycznych, zarówno przy wykrywaniu patogenów roślin, jak i zwierząt. Sprzężenie LAMP z reakcją odwrotnej transkrypcji, czyni z tej techniki niezwykle użyteczne narzędzie do diagnostyki wirusów RNA między innymi takich jak: wirus zapalenia wątroby typu B, wirus zachodniego Nilu, czy też wirusy roślinne (wirus Y ziemniaka). RT-LAMP jest metodą jednoetapową (odwrotna transkrypcja i amplifikacja przebiegają w jednej mieszaninie reakcyjnej), szybką, czułą i specyficzną, przez co stanowi poważną konkurencję dla RT-PCR.
LAMP znajduje też zastosowanie w detekcji mikrobiologicznych zanieczyszczeń żywności takich jak paciorkowce w mleku, czy też bakterie z rodzaju Salmonella i Listeria. W miarę rozwoju techniki i jej adaptowania przez różne gałęzie biologii powstają nowe rozwiązania takie jak chipy – które są coraz bardziej zbliżone do małych przenośnych laboratoriów które pozwalają nie tylko na detekcję ale także na identyfikację mikorganizmów oraz, w połączeniu z bardziej złożonymi technikami, na ultraczułą detekcję metabolitów takich jak mykotoskyny.
Nie ulega wątpliwości że biologia molekularna jest jedną z najbardziej dynamicznie rozwijających się dziedzin nauki. Mając na uwadze ewolucję jaką w ciągu trzech dekad przeszedł klasyczny PCR, w efekcie której powstały jego modyfikacje takie jak nano PCR, multiplex PCR czy qPCR, tym bardziej interesujące staje się śledzenie rozwoju techniki LAMP która oferuje nowe podejście i wydaje się mieć potencjał co najmniej równy metodzie opracowanej przez Mullisa.
Literatura:
- Ciszkowicz E. (2012). Wykorzystanie izotermalnej amplifikacji DNA za pośrednictwem pętli w diagnostyce roślin, Postępy Biologii Komórki, 39(4),
- Fang, X., Chen, H., Xu, L., Jiang, X., Wu, W., & Kong, J. (2012). A portable and integrated nucleic acid amplification microfluidic chip for identifying bacteria. Lab on a Chip, 12(8), 1495-1499.
- http://loopamp.eiken.co.jp/e/lamp/principle.html
- Los, A., Kadhim, M.J., Olszewski, K. (2016). LAMP – a method of isothermal DNA amplification. Medycyna Weterynaryjna-Veterinary Medicine-Science and Practice 72(1), 22-27.
- Mikš-Krajnik, M., Lim, H. S. Y., Zheng, Q., Turner, M., & Yuk, H. G. (2016). Loop-mediated isothermal amplification (LAMP) coupled with bioluminescence for the detection of Listeria monocytogenes at low levels on food contact surfaces. Food Control, 60, 237-240
- Mori, Y., Notomi, T., (2009). Loop-mediated isothermal amplification (LAMP): a rapid, accurate, and cost-effective diagnostic method for infectious diseases. Journal of Infection and Chemotherapy 15(2), 62-69.
- Notomi, T., Mori, Y., Tomita, N., Kanda, H. (2015). Loop-mediated isothermal amplification (LAMP): principle, features, and future prospects. Journal of Microbiology 53(1), 1-5.
- Notomi, T., Okayama, H., Masubuchi, H., Yonekawa, T., Watanabe, K., Amino, N., Hase, T., (2000). Loop-mediated isothermal amplification of DNA. Nucleic Acids Research 28(12).
- Parida, M., Posadas, G., Inoue, S., Hasebe, F., & Morita, K. (2004). Real-time reverse transcription loop-mediated isothermal amplification for rapid detection of West Nile virus. Journal of clinical microbiology, 42(1), 257-263.
- Sun, Y., Quyen, T. L., Hung, T. Q., Chin, W. H., Wolff, A., & Bang, D. D. (2015). A lab-on-a-chip system with integrated sample preparation and loop-mediated isothermal amplification for rapid and quantitative detection of Salmonella spp. in food samples. Lab on a Chip, 15(8), 1898-1904
- Tomita N, Mori Y, Kanda H, Notomi T. (2008). Loop-mediated isothermal amplification (LAMP) of gene sequences and simple visual detection of products. Nat. Protoc. 3:877–882
- Zhang, X., Liao, M., Jiao, P., Luo, K., Zhang, H., Ren, T., … & Cao, W. (2010). Development of a loop-mediated isothermal amplification assay for rapid detection of subgroup J avian leukosis virus. Journal of clinical microbiology, 48(6), 2116-2121.

