Sensory chemiczne są to urządzenia przetwarzające informację chemiczną na parametry nadające się do obróbki. Jednym z ich rodzajów są tak zwane biosensory, w których część receptorową tworzy materiał biologiczny. Przedrostek „-bio” odnosi się zatem do rodzaju czujnika, nie zaś do typu oznaczanej substancji. Biosensory cechują się dużą selektywnością i powinowactwem względem badanego związku i przez to stanowią ważny krok w rozwoju metod analitycznych.
Tak się zaczęło
Początek badań nad biosensorami datuje się na rok 1962, w którym Clark i Lyons opisali tak zwaną elektrodę enzymatyczną. Ten pierwszy bioczujnik służył do wykrywania glukozy i wykorzystywał oksydazę glukozową immobilizowaną na platynowej elektrodzie.
Budowa sensorów
W skład każdego biosensora wchodzą dwa podstawowe elementy:
• warstwa analitycznie aktywna, czyli część receptorowa lub inaczej element czuły – tutaj następuje proces rozpoznania międzymolekularnego receptor-analit, w trakcie którego wytworzony zostaje sygnał chemiczny lub fizykochemiczny, np. dotyczący stężenia jakiegoś konkretnego składnika próbki. W biosensorach warstwę analitycznie aktywną tworzy materiał biologiczny, najczęściej unieruchomiony na odpowiednim nośniku. Jego rodzaj wpływa na selektywność i czułość względem badanej substancji. Ważne jest, aby część receptorowa była stabilna w warunkach prowadzonego eksperymentu. Istotna jest także gęstość upakowania sond na powierzchni przetwornika, np. w przypadku biosensora opartego na reakcji hybrydyzacji, zbyt duża gęstość może utrudniać proces rozpoznania, natomiast zbyt luźna wzmaga ryzyko wystąpienia niespecyficznej adsorbcji na powierzchni elektrody;
• element przetwornikowy (transducer) – dzięki niemu sygnał, otrzymany w warstwie analitycznie aktywne,j zostaje zamieniony na parametr mierzalny, tzn. nadający się do obróbki. Wynik pomiaru może być przedstawiany w formie analogowej, odejmowany od sygnału odniesienia, a także przetworzony na sygnał cyfrowy i opracowywany statystycznie.
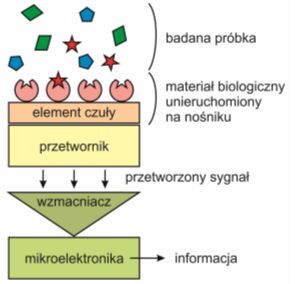
Rys.1. Ogólny schemat budowy biosensora.
Parametry użytkowe biosensorów
O praktycznej przydatności biosensorów decydują:
• dokładność,
• powtarzalność wyników;
• czułość, powinowactwo – wartość emitowanego sygnału na jednostkę stężenia;
• zakres dynamiczny – zakres stężeń, w których czułość jest większa od zera;
• selektywność, czyli specyficzność względem badanej substancji – zdolność sensora do pomiaru stężenia jednego chemicznego składnika w obecności innych;
• czas odpowiedzi lub inaczej szybkość czasu detekcji;
• czas życia, czyli trwałość sensora, uzależniona zarówno od jego rodzaju, jak i trybu stosowania i przechowywania.
Podział biosensorów ze względu na rodzaj przetwornika
Rodzaj zastosowanego przetwornika warunkuje rodzaj odbieranego sygnału i wpływa na czułość sensora. Wyróżnia się m.in. bioczujniki:
• optyczne, wykorzystujące pomiary świetlne dokonywane w aparatach optycznych, takich jak np. spektrofotometry, fluorometry, lumenometry oraz fotometry;
• piezoelektryczne, które przetwarzają zmiany kształtu na napięcia elektryczne i wskazują najczęściej na zmiany masy, np. mikroorganizmów;
• termometryczne;
• magnetyczne;
• elektrochemiczne – potencjometryczne lub amperometryczne.
Podział biosensorów ze względu na element czuły
Dobór części czułej bioreceptora warunkowany jest rodzajem identyfikowanego analitu. Ze względu na typ użytego materiału biologicznego wyróżnia się:
• biosensory enzymatyczne
Na przykład biosensory bazujące na tyrozynazie lub peroksydazie i stosowane do monitoringu związków fenolowych, hydrolazy fosforoorganicznej oraz cholinoesterazy (fosfoorganiczne pestycydy są inhibitorami cholinoesterazy). Ich wadą jest słaba długoterminowa aktywność. Alternatywą mogą być biosensory jednorazowe.
• immunosensory
W tym przypadku warstwę czułą tworzą przeciwciała monoklonalne (tzn. pochodzące z jednego klonu limfocytu B i w związku z tym wykazujące w jednakową swoistość względem danego antygenu) lub poliklonalne (takie, które różnią się miedzy sobą składem łańcuchów ciężkich i lekkich, i przez to wykazują różne powinowactwo względem epitopów danego antygenu).
Można je wykorzystywać do bezpośredniej detekcji lub też w systemach, w których wiązany antygen konkuruje z analitem o miejsce na przeciwciele.
W produkcji biosensorów istotna jest stabilność użytych immunoglobulin, które powinny być odporne na zmiany środowiska, takie jak np. wysoka lub niska temperatura. Jest to niezbędne zwłaszcza w przypadku przeprowadzania analiz ciągłych.
Wadą tego typu biosensorów jest stosunkowo duża cena, wynikająca z wysokich kosztów produkcji odpowiednich przeciwciał. Dodatkowo nie mogą być one wykorzystywane w przypadku zbyt małych molekuł lub cząstek z niską immunogennością i wysoką toksycznością.
• biosensory wykorzystujące kwasy nukleinowe
Jest to stosunkowo nowa grupa biosensorów, która szybko znalazła zastosowanie podczas wykrywania mutacji w sekwencjach genetycznych, zanieczyszczeń w przemyśle farmaceutycznym oraz w badaniach nad uwolnieniem genetycznie zmodyfikowanych mikroorganizmów do środowiska.
Tego typu biosensory mogą zawierać pojedyncze lub dwuniciowe łańcuchy DNA lub RNA, hybrydyzujące ze specyficznymi dla siebie sekwencjami komplementarnymi, niskocząsteczkowymi związkami chemicznymi (toksyny, leki) lub też białkami wykazującymi powinowactwo do kwasów nukleinowych.
Istnieją również typy biosensorów, w których elementem czułym jest kwas peptydonukleinowy (ang. Peptide Nucleic Acid, PNA) unieruchomiony na nośniku za pomocą wiązań peptydowych lub za pośrednictwem cząsteczek łącznikowych. W odróżnieniu od DNA i jego analogów, PNA nie zawiera pentoz ani grup fosforanowych, jednak mimo to jest w stanie naśladować DNA i w podobny sposób łączyć się z komplementarnymi sekwencjami. Może się on również łączyć się z odpowiednimi cząsteczkami RNA.
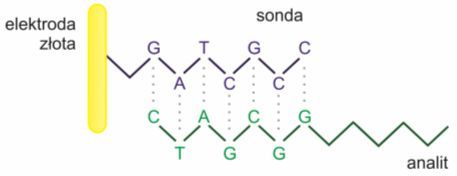
Rys. 2. Hybrydyzacja cząsteczki analitu z komplementarną sondą biosensora.
Najbardziej pożądane są kilkunastonukleotydowe sekwencje DNA i RNA, wykazujące wysoką specyficzność i powinowactwo względem wiązanego analitu. Nazywa się je aptamerami, od łacińskiego słowa aptus, to znaczy przyczepiony, dopasowany.
Ich zastosowanie pozwala otrzymać sondy wykazujące powinowactwo do praktycznie każdego badanego związku. Siła z jaką aptamery wiążą się z rozpoznawaną molekułą, jest porównywalna z oddziaływaniami zachodzącymi między przeciwciałem monoklonalnym i jego specyficznym antygenem. Tak wysoka stabilność kompleksu warunkowana jest niezwykłym dopasowaniem przestrzennej struktury aptameru i analitu.
Ze względu na małe rozmiary aptamery mogą być również gęsto upakowane na powierzchni biosensora. Ponadto, cechują się one dużą stabilnością, którą można dodatkowo zwiększyć stosując chemicznie modyfikowane nukleotydy. Dzięki temu, przez wiele cykli, łańcuchy nie tracą swoich właściwości, nawet wtedy, kiedy są poddawane termicznej denaturacji oraz renaturacji.
Aptamery nie wymagają stosowania kultur komórkowych ani organizmów zwierzęcych i w związku z tym można je uzyskiwać w dużych ilościach oraz stosunkowo małym kosztem. Sekwencje o pożądanych właściwościach fizycznych i chemicznych selekcjonuje w warunkach in vitro dzięki tzw. metodzie SELEX (ang. systematic evolution of ligands by exponential enrichment).
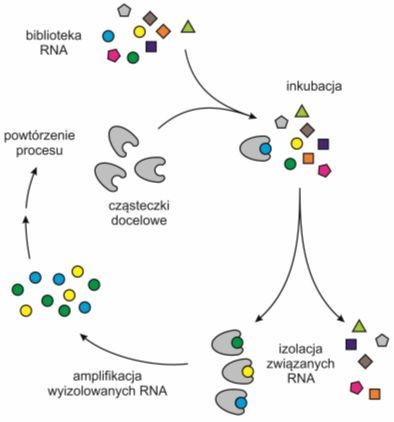
Rys. 3. Poszukiwanie aptameru RNA w bibliotece RNA za pomocą metody SELEX.
• translacyjne biosensory
Łącząc aptamer RNA z domeną regulacyjną RNA można, za pomocą właściwego ligandu, regulować ekspresję danego genu. Są to tzw. biosensory translacyjne.
Połączenie aptameru z ligandem wywołuje zmiany konformacyjne czujnika RNA. Prowadzi to do uwolnienia domeny antysensowej (uaktywnienie sekwencji) lub jej związania w stabilną pętlę (unieczynnienie). Próg wykrywalności reguluje się za pomocą zmian w sekwencji RNA.
Do produkcji tego typu sensorów można stosować aptamery specyficzne dla różnych ligandów oraz sekwencje antysensowne dla różnych genów.
• biosensory receptorowe
Ten typ biosensorów składa się z błonowych białek receptorowych wyzwalających białkowe kaskady sygnałowe.
Stosowane receptory mogą być konstruowane de novo na poziomie molekularnym, tak, aby wiązały określony ligand, np. kancerogeny, trinitrotoluen TNT, medycznie istotne metabolity (L-lactate) i związki związane z kondycja psychiczną (serotonina).
• biosensory wykorzystujące wirusy
Do konstruowania tego typu biosensorów najczęściej stosuje się bakteriofagi, czyli wirusy infekujące bakterie. Działają one z wysoką selektywnością i czułością, a ponadto cechują się dobrą chemiczną i termiczną stabilnością. Mogą być one również łączone z innymi biomolekułami i nanomateriałami oraz immobilizowane na powierzchni przetwornika urządzenia analitycznego.
Wirusy o powinowactwie do konkretnego ligandu odnajduje się dzięki tzw. fagowej ekspresji peptydów (ang. phage display). Specyficzność względem badanego analitu można również uzyskać dzięki odpowiednim modyfikacjom.
W produkcji biosensorów wykorzystuje się zarówno fagi nielityczne (takie jak M13 i fd), stosowane jako substytuty przeciwciał, jak i fagi lityczne (T4 lub T7). Te ostatnie niszczą komórki gospodarza u uwalniają zawarte w niej markerów, np. enzymy. Ich zastosowanie umożliwia wykrywanie specyficznych szczepów bakterii.
• biosensory wykorzystujące mikroorganizmy
Pierwsze biosensory tego typu wykorzystywano do detekcji BZT, czyli biochemicznego zapotrzebowania tlenu (ang. biochemical oxygen demand, B.O.D.). Obecnie stosuje się je również do pomiarów związków toksycznych zawartych w środowisku.
Ich główną zaletą jest niska cena i to, że są łatwe do skonstruowania.
Obecnie wykorzystuje się również mikroorganizmy modyfikowane genetycznie i posiadające na swojej powierzchni odpowiednie detektory, takie jak np. pojedyncze łańcuchy fragmentów przeciwciał (scFvs). Ich użycie pozwala ominąć kosztowny etap oczyszczania enzymów.
• biosensory transkrypcyjne
Transkrypcja jest pierwszym etapem ekspresji genów, a jej regulacja stanowi jedną z metod odpowiedzi na zmieniające się warunki środowiska. Maszyneria transkrypcyjna, tj. geny ulegające ekspresji, ich promotory, polimeraza RNA i czynniki transkrypcyjne, mogą być wykorzystywane do tworzenia odpowiednich biosensorów.
Ten typ czujników wykorzystuje m.in. promotory, których aktywność warunkowana jest zmianami środowiska, tzn. zmiany w ekspresji genów zachodzą w sposób zależny od obecności induktora, czyli odpowiedniego ligandu. Jest to tzw. system indukowanej ekspresji, którą można uwidaczniać za pomocą ekspresji fluorescencyjnego reportera lub też zachodzących zmian fenotypowych, np. formowanie biofilmu, apoptoza.
Niekiedy pojedyncze sygnały są niewystarczające. W takich wypadkach wykorzystuje się tzw. bramki AND, które przekształcają złożone sygnały i pozwalają na odpowiednie dobranie wrażliwości biosensora.
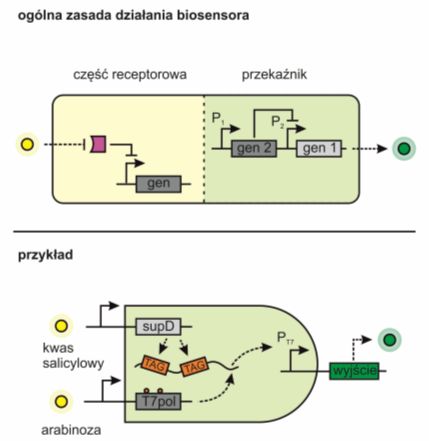
Rys.4. Przykład biosensora transkrypcyjnego. Na przedstawionym przykładzie transkrypcyjna bramka logiczna AND (układ realizujący fizycznie prostą funkcję logiczną, tutaj koniunkcję, iloczyn), została zaprojektowana w taki sposób, aby odbierać i przekazywać jedynie równoczesną obecność dwóch analitów: kwasu salicylowego i arabinozy. Na jednym wejściu do bramki znajduje się promotor, który w odpowiedzi na pojedynczy sygnał, tzn. obecność arabinozy, aktywuje transkrypcję genów T7 RNA polimeraz. Gen ten zawiera wewnętrznie kodowany kodon amber (stop), blokujący translację transkryptu. Kluczem do odblokowania translacji jest aktywacja drugiego wejścia. Innymi słowy, polimeraza T7RNA może ulegać dokładnej ekspresji tylko w obecności dwóch sygnałów środowiskowych.
Zastosowanie biosensorów
Biosensory pozwalają na identyfikację obcego DNA, białek, szeregu metabolitów i skażeń chemicznych (toksyny) oraz biologicznych (wirusy, bakterie).
Atrakcyjność stosowania bioczujników wynika głównie z ich wysokiej czułości i selektywności względem badanej substancji. Dzięki tej właściwości pozwalają one w sposób prosty i szybki oznaczyć interesujący nas składnik nawet w złożonej mieszaninie, np. w produkcie spożywczym.
Bioczujniki mogą być stosowane zwykle przez kilka tygodni, a nawet miesięcy i wykonywać w tym czasie setki pomiarów. Obniża to znacznie koszty analizy. Dokonywane pomiary nie wymagają również pracochłonnego przygotowywania badanej próby. Dzięki temu biosensory stanowią niezastąpione narzędzie wykorzystywane podczas monitoringu środowiska, tzn. obserwacji wybranych cech środowiska z wykorzystaniem ciągłych lub stale powtarzanych pomiarów.
Stosowane są one m.in. do określania ilości metali ciężkich, pestycydów, BZT, azotu, fosforu, lotnych substancji organicznych, patogenów, substancji rakotwórczych i toksycznych (pestycydów, mykotoksyn, antybiotyków) w powietrzu, wodzie i glebie. Ich użycie uzupełnia dane uzyskane z analiz laboratoryjnych, a analizy te są niezbędne do zapewnienia bezpieczeństwa i zdrowia oraz do kontrolowania skuteczności fizycznej, chemicznej i biologicznej kontroli zanieczyszczeń.
Biosensory wykorzystuje się również do kontroli żywności m.in. przy identyfikacji organizmów genetycznie zmodyfikowanych.
Ponadto umożliwiają one wykrywanie śladowych ilości materiałów wybuchowych używanych w bioterroryzmie.
Rys. 5. Przykładowe zastosowanie biosensorów.
Dzięki miniaturyzacji, biosensory umożliwiają uzyskanie dużej czułości przy minimalnej ingerencji w funkcjonowanie komórki. Zastosowanie w żywych komórkach biosensorów bazujących na fluorescencyjnych białkach pozwala na wizualizowanie procesów zachodzących w komórkach w czasie rzeczywistym (ang. real time).
Pomaga to zrozumieć, w jaki sposób komórka odpowiada na odbierane sygnały środowiskowe i jest bardzo pomocne m.in. przy poszukiwaniu nowych celów terapeutycznych w walce z niektórymi chorobami. Tego typu biosensory uwidaczniają aktywność kinaz i fosfataz, dynamikę przekaźników drugorzędowych i metabolitów takich jak glukoza, a także wizualizują sposoby łączenia się receptorów i efektorów. Dzięki nim poznano wiele mechanizmów czasoprzestrzennej regulacji zdarzeń zachodzących wewnątrz sieci sygnalnych.
Autor: Anna Kurcek
Literatura:
1. Bassi A. S., Recent Advances in Biosensor Research for Environmental Applications. AllBusiness.com.
2. Biśta M., Fagowa ekspresja peptydów. bioinfo.mol.uj.edu.pl.
3. DiPilato L. M, Zhang J., 2010. Fluorescent protein-based biosensors: resolving spatiotemporal dynamics of signaling. Curr Opin Chem Biol. 14(1): 37.
4. Khalil A. S., Collins J. J., 2010. Synthetic Biology:Applications Come of Age. Nat Rev Genet. 11 (5): 267-379.
5. Ligler F.S., 2009. A Perspective on Optical Biosensors and Integrated Sensor Systems. Anal Chem. 2009 January 15; 81(2): 519–526.
6. Liu J., Cao Z., Lu Y., 2009. Functional Nucleic Acid Sensors Chem Rev. 109(5): 1948–1998.
7. Mao Ch., Liu A., Cao B., 2009. Virus-Based Chemical and Biological Sensing. Angew Chem Int Ed Engl. 48(37): 6790–6810.
8. Radecki J. , Radecka H., Cieśla J. Tudek B. 2006. Sensory chemiczne i biosensory w kontroli żywności zmodyfikowanej Genetycznie. Biotechnologia. 3 (74): 67–78.
9. Tuzel A., Wszechstronne detektory – aptamery nukleinowe. bioinfo.mol.uj.edu.pl.

