Rośliny transgeniczne (ang. genetically modified plants) są to rośliny, które w swoich komórkach zawierają obcy DNA. Głównym celem tego typu modyfikacji jest wykorzystanie potencjału produkcyjnego oraz poprawienie wartości użytkowej hodowanych organizmów. Obce geny wprowadza się do komórek biorcy za pomocą metod inżynierii genetycznej.
Czym są rośliny transgeniczne?
Rośliny transgeniczne, lub inaczej rośliny genetycznie zmodyfikowane, są to organizmy roślinne, których materiał genetyczny został zmieniony w celu uzyskania pożądanego fenotypu. Ustawa o organizmach genetycznie zmodyfikowanych z dnia 22 czerwca 2001 r. zastrzega, że zmiany te muszą być dokonywane metodami inżynierii genetycznej, tzn. sposobem, jaki nie może mieć miejsca w warunkach naturalnych. Stosowane od wieków metody poprawy jakości plonów, takie jak np. krzyżowanie, selekcja oraz wywoływanie mutacji nie prowadzą zatem do otrzymania roślin transgenicznych.
Po co się je tworzy?
Celem każdej hodowli jest takie ukształtowanie genotypu odmian roślin uprawnych, aby uzyskały one pożądane cechy użytkowe. Prowadzenie hodowli roślin transgenicznych jest jedynie kolejnym krokiem zmniejszających ryzyko tego typu przedsięwzięć.
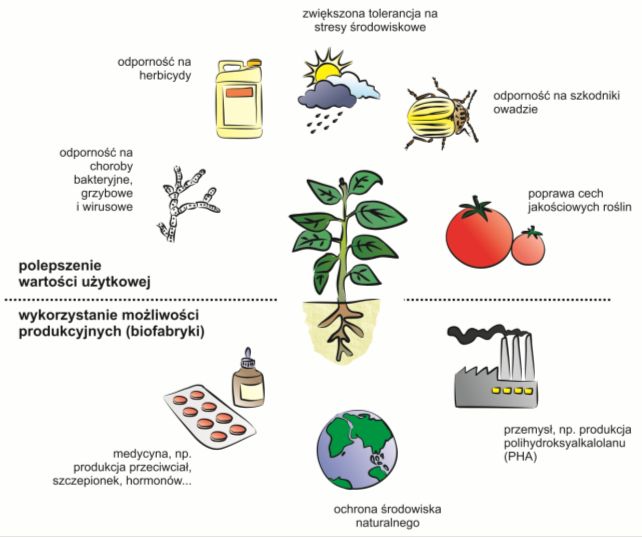
Rys. 1. Przykładowe możliwości zastosowania roślin transgenicznych
Według Międzynarodowej Organizacji ds. Zastosowań Biotechnologii w Rolnictwie (ang. International Service for the Acquisition of Agri-biotech Applications, ISAAA) ubiegły rok był bardzo korzystny dla upraw GMO. Globalna powierzchnia upraw transgenicznych roślin wzrosła na świecie o około 10%, to znaczy do 148 mln hektarów. Zwiększające się zainteresowanie tego typu hodowlą tłumaczone jest głównie wzrostem cen surowców rolnych.
Największy bezwzględny wzrost powierzchni upraw GMO odnotowano w Brazylii. Zdecydowanym liderem wciąż pozostają jednak Stany Zjednoczone, w których powierzchnia transgenicznych upraw sięga 66,8 mln hektarów. W Polsce rejestr wszystkich genetycznie zmodyfikowanych organizmów jest prowadzony przez Ministerstwo Środowiska i dostępny na stronie http://gmo.mos.gov.pl/usage/register/index.php?site=main.
Najczęściej hodowanymi roślinami transgenicznymi są bawełna kukurydza, rzepak i soja. Uprawia się je obecnie w 29 krajach. Najpopularniejszym typem modyfikacji jest natomiast odporność na herbicydy.
Tab. 1. Przykłady roślin zmodyfikowanych genetycznie, zarejestrowanych na terenie Unii Europejskiej i wykorzystywanych jako jedzenie i pasze (według danych Komisji Europejskiej)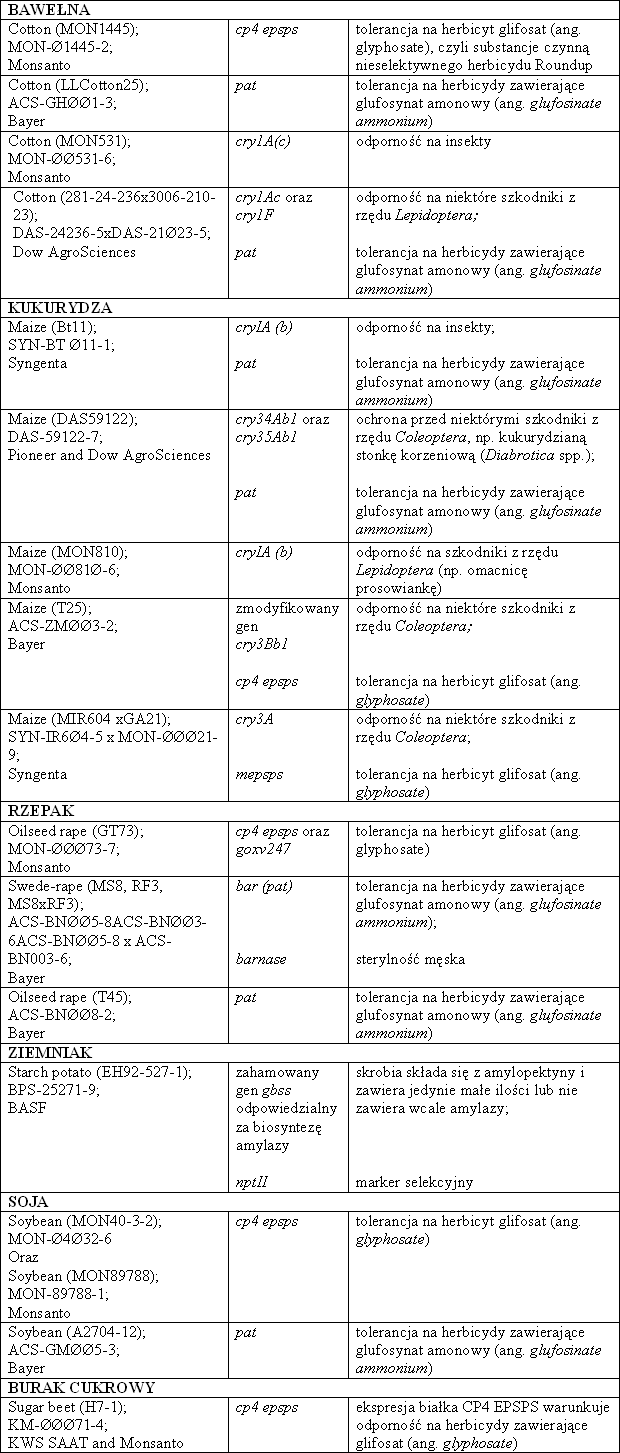
Jak się je otrzymuje?
Uzyskiwanie roślin transgenicznych jest złożonym procesem. Wprowadzane do rośliny geny są izolowane i konstruowane metodami inżynierii genetycznej, a następnie wprowadzane do komórek modyfikowanej rośliny. Wyselekcjonowane komórki poddaje się ostatecznie regeneracji w warunkach in vitro i w ten sposób uzyskuje się kompletną roślinę.
Nie bez znaczenia pozostaje wybór odmiany rośliny poddawanej transformacji.
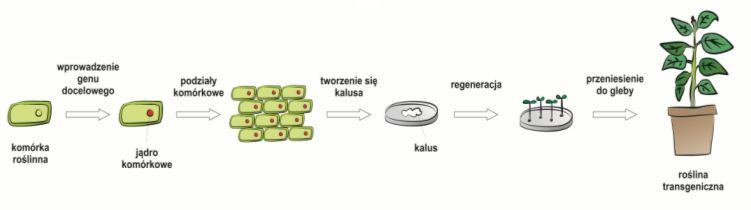
Rys. 2. Etapy transformacji organizmów roślinnych
Izolacja genów
Pierwszym krokiem do przeprowadzenia modyfikacji genetycznej jest izolacja genu, który ma zostać wprowadzony do komórek biorcy. Etap ten limitowany jest głównie stanem wiedzy na temat mechanizmów powstawania pożądanej cechy oraz mechanizmów warunkujących ekspresję danego genu. Należy pamiętać, że większość cech powstaje w wyniku działania złożonych szlaków metabolicznych. Ich zmiany można zatem indukować za pomocą różnych genów, a ich wybór powinien uwzględnić ewentualne efekty uboczne, takie jak zakłócenie innych procesów rozwojowych rośliny.
Odpowiedniego genu można szukać bezpośrednio w komórkach obiektu zainteresowań, tzn. w genomie badanego organizmu lub też w specjalnych bibliotekach genomowych, zwanych również bankami genowymi.
Ogólnie strategie izolacji można podzielić na dwie podstawowe grupy: klonowanie funkcjonalne i pozycyjne.
• klonowanie funkcjonalne, zwane również izolacją funkcjonalną. Stosuje się je w przypadku, kiedy znana jest funkcja izolowanego genu.
Zakłada się, że mechanizmy kontroli podobnych cech lub procesów są analogiczne w różnych organizmach, nawet tych odległych od siebie taksonomicznie. Dzięki temu sekwencje pochodzące od danego gatunku można zastosować do konstrukcji sond, służących do izolacji genów pochodzących z innych rodzajów lub rodzin. Do konstrukcji sond można wykorzystywać zarówno sekwencję genu kodującego analogiczną cechę, jak też mRNA i sekwencje aminokwasowe kodowanych białek. Gdy znana jest sekwencja heterologiczna, to znaczy wykazująca niezgodność, wtedy do przeszukiwania biblioteki na ogół wybiera się tylko taki jej fragment, który jest konserwatywny dla danej grupy organizmów.
Zbliżoną strategią jest klonowanie funkcjonalne oparte na wykorzystaniu interakcji białko – białko lub białko – kwas nukleinowy. W tym przypadku jednak rozpoznawane są nie dane sekwencje genowe, a produkty ich ekspresji. Klonowany DNA umieszcza się zatem w tak zwanych wektorach ekspresyjnych, pozwalających na wydajną syntezę kodowanego białka. Produkty translacji są oznakowane przez specyficzne systemy rozpoznające (np. przeciwciała i ligandy), umożliwiające ich izolację i identyfikację.
Inną techniką jest tak zwane tagowanie genów (ang. gene tagging, gene trapping, gene hunting). Polega ono na wprowadzeniu do genu znanej sekwencji tagującej, stanowiącej swego rodzaju sondę. Gen identyfikuje wywołana insercją mutacja.
• klonowanie pozycyjne, czyli tak zwana izolacja pozycyjna określana również mianem odwrotnej genetyki. Stosuje się ją w przypadkach, gdy nie jest znana funkcja badanego genu, a jedynie jego położenie w genomie lub informacja o jego sprzężeniu z odpowiednimi markerami.
Jednym z tego typu strategii jest wykorzystywanie map genetycznych. Innym sposobem jest tzw. analiza porównawcza puli kwasów nukleinowych i białek. Tego typu różnice powstają w wyniku zróżnicowanej ekspresji genów, pozostającej pod kontrolą zarówno czynników dziedzicznych, jak i niedziedzicznych.
Charakterystyka genu
Wyodrębniony gen powinien zostać dobrze scharakteryzowany. Należy zatem określić jego położenie, strukturę, ekspresję oraz pełnioną funkcję.
Określenie pozycji, jaką dany fragment DNA zajmuje na mapie genomu, pozwala zrozumieć jego relacje z sąsiadującymi sekwencjami. W zależności od sposobu konstrukcji, wyróżnić można mapy rekombinacyjne (położenie genów względem siebie jest w nich relatywne) i fizyczne (przedstawiają rzeczywiste odległości między markerami). Do poprawnej identyfikacji genu niezbędne jest również poznanie jego struktury. Jej znajomość wykorzystuje się między innymi w przypadku konieczności modyfikacji funkcji danego genu. Funkcja genu, czyli rola jaką pełni on w żywym organizmie, nie jest pojęciem równoznacznym z jego ekspresją, wskazującą jedynie na obecność produktów kodowanych przez dany gen, tzn. RNA, białek.
Tworzenie konstrukcji genowych
Aby wyizolowany gen można było wprowadzić do komórek biorcy, niezbędne jest utworzenie tzw. konstruktu genowego, zawierającego:
• transgen, czyli sekwencję kodującą białko będące przedmiotem modyfikacji. Jego organizacja i orientacja zależy od przyjętej strategii modyfikacji, to znaczy od rodzaju zmian jakie ma on wywołać w modyfikowanej roślinie, np. nadekspresję, represję.
• sekwencje regulatorowe, takie jak promotor i terminator transkrypcji, które wraz sekwencjami wzmacniającymi i wygaszającymi ekspresję genu, stanowią tak zwane cis-elementy regulujące aktywność danego fragmentu. Ważną rolę odgrywają także czynniki trans, czyli produkty ekspresji innych genów.
Obecność promotora jest niezbędna do tego, aby zainicjować ekspresję danego genu w komórkach roślinnych. Powszechnie używany jest promotor nieswoisty 35S wirusa mozaiki kalafiora CaMV, warunkujący ekspresję ciągłą (konstytucyjną) i występującą we wszystkich częściach rośliny. W niektórych przypadkach konieczne jest zastosowanie tzw. promotorów tkankowo specyficznych, warunkujących ekspresję lokalną. Przykładowo stosuje się je w przypadku manipulacji pirofosforylazą ADP-glukozylową bioracą udział w syntezie skrobi. Gdy produkt obcego genu wpływa na wzrost i rozwój rośliny lub też gdy obcy gen ma ulegać ekspresji w określonym czasie i miejscu, najkorzystniejsze jest zastosowanie tzw. promotorów aktywowanych, to znaczy indukowanych, np. działaniem promieni nadfioletowych, tetracykliną, czy też glikokortykoidami.
Sekwencja terminatorowa warunkuje zakończenie transkrypcji genu. Bierze ona również udział w poliadenylacji powstałego mRNA.
• gen markerowy, pozwalający wyselekcjonować transformowane komórki.
Selekcja transgenicznych komórek i tkanek powinna wyeliminować lub osłabić komórki, które nie uległy transformacji. Wybór strategii selekcji zależy głównie od zastosowanego promotora i genu markerowego, reakcji badanych tkanek i sposobu ich regeneracji. Procedurę selekcji można zatem ustalić jedynie w sposób doświadczalny.
Najczęściej stosowane są geny odporności na antybiotyki (kanamycynę, neomycynę, paranomycynę, higromycynę) lub herbicydy (glifosat). Podczas hodowli na pożywce zawierającej taki toksyczny związek, giną tylko te komórki, w których nie zaszła ekspresja genu odporności. Najlepiej widocznym objawem jest postępująca chloroza tkanek.
Innym sposobem jest stosowanie czynników wywierających pozytywny wpływ na komórki transgeniczne.
• geny reporterowe, umożliwiające identyfikację transformowanych komórek.
Przykładem takich genów mogą być gen β-glukuronidazy (GUS) z E.coli i geny białek fluoryzujących, takie jak białko zielono fluoryzujące (ang. green fluorescent protein, GFP). W wyniku ich ekspresji powstają łatwo dostrzegalne zmiany fenotypowe, np. produkcja barwnika, którego obecność można zaobserwować pod mikroskopem lub za pomocą spektrofotometru. Zmiany te nie mogą powodować żadnych zakłóceń w organizmie biorcy.
Podstawą wartości użytkowej roślin są produkty wieloetapowych procesów kontrolowanych przez wiele genów. Sterowanie nimi wymaga zastosowania tzw. transformacji konstruktem wielogenowym.
Wprowadzanie genów do roślin
Proces wprowadzania do komórki obcego materiału genetycznego określa się mianem transformacji genetycznej lub inaczej transgenizacji, transgenezy. Najbardziej kompetentne do transformacji są komórki merystemetyczne o gęstej cytoplazmie, występujące m.in. w zarodkach i młodych siewkach. Można również wykorzystywać eksplantaty uzyskiwane z kultur in vitro.
W przypadku roślin, podstawową przeszkodę stanowi ścian komórkowa, otaczająca błonę i izolująca komórkę od otaczającego ją środowiska zewnętrznego. Z tego powodu, poddawane transformacji komórki pozbawia się wcześniej ściany komórkowej.
Obecnie znanych jest kilkanaście metod wprowadzania genów do komórek. Można je podzielić na dwie główne kategorie, czyli metody wektorowe i bezwektorowe.
• metody wektorowe transformacji roślin
Podstawową metodą wektorową jest tak zwana agroinfekcja. Wykorzystuje ona naturalne zdolności niektórych bakterii z rodzaju Agrobacterium do infekowania zranionych roślin i przekazywania im tzw. T-DNA, czyli części kolistego plazmidu replikującego niezależnie od chromosomu bakteryjnego. Zawarte w plazmidzie geny ulegają następnie integracji z genomem komórki roślinnej. W przypadku Agrobacterium tumefaciens (plazmid Ti, ang. tumor inducing) efektem infekcji jest choroba zwana guzowatością korzeni i objawiająca się wytworzeniem na roślinie rakowatych narośli. Agrobacterium rhizogenes (plazmid Ri, ang. root inducing) powoduje powstawanie dużej liczby korzeni włośnikowych, których główną rolą jest pobieranie wody i soli mineralnych z podłoża. Ten naturalny system transformacji modyfikuje się w taki sposób, aby szkodliwe dla rośliny geny zostały zastąpione przez sekwencje warunkujące występowanie pożądanych cech.
Agroinfekcja jest prowadzona głównie w kulturach in vitro biorcy, z których wybiera się najlepiej regenerujące eksplantaty, a następnie umieszcza się je w roztworze zawierającym Agrobacterium. Etap ten nosi nazwę inokulacji. Po upływie odpowiedniego czasu, nadmiar bakterii opłukuje się wodą lub płynną pożywką i suszy na bibule filtracyjnej. Tak przygotowane eksplantaty umieszcza się na odpowiednim medium stymulującym regenerację pędów i zawierającym antybiotyki eliminujące pozostałe bakterie. Ostatnim etapem jest regeneracja całych roślin.
Możliwe jest również dokonanie transformacji bez prowadzenia kultury in vitro. Inokulum wprowadza się wówczas do tych części roślin, w których zachodzą intensywne podziały mitotyczne lub mejotyczne, czyli np. do stożków wzrostu i liścieni. W kulturze bakteryjnej można również moczyć nasiona.
Agroinfekcja jest procesem złożonym, a jej powodzenie w dużym stopniu zależy od właściwości zastosowanych bakterii i infekowanej tkanki roślinnej. Nie bez znaczenia pozostają tutaj wiek i gatunek rośliny, typ transformowanej tkanki, a także rodzaj szczepu bakterii i zastosowanej metodyki transformacji. Intensywność transformacji za pośrednictwem Agrobacterium mierzy się najczęściej liczbą pędów zregenerowanych w warunkach selekcyjnych po potwierdzonej integracji transgenu w stosunku do liczby inokulowanych eksplantatów. Innym sposobem jest określenie udziału eksplantatów z których zregenerowano co najmniej jedną roślinę transgeniczną.
Metoda ta cechuje się dużą wydajnością, tzn. wysoką częstość integracji fragmentu T z genomem roślinnym. Zapewnia ona również ochronę wprowadzanego transgenu i pozwala na jednoczesne wprowadzenie kilku szczepów bakteryjnych zawierających różne geny. Jest ona jednak mało skuteczna w przypadku roślin jednoliściennych, które nie syntetyzują induktorów w zranionych częściach eksplantatu.
• metody bezwektorowe transformacji roślin
Metoda chemiczna
Stosuje się ją w przypadku protoplastów, u których za pomocą glikolu polietylenowego (PEG) można wywołać odwracalną dezorganizację błony komórkowej i zwiększyć tym samym jej przepuszczalność. W ten sposób, zawarte w pożywce cząsteczki DNA mogą wniknąć do wnętrza komórki.
Elektroporacja
Przepuszczalność błony komórkowej można również zwiększyć działając na nią polem elektrycznym. Istotny wpływ mają tu takie czynniki jak: pojemność elektryczna, napięcie prądu, czas trwania impulsu elektrycznego, czas inkubacji protoplastów i plazmidu przed i po elektroporacji, temperatura roztworu oraz gęstość plazmidu.
Wyróżnić można trzy podstawowe strategie tej metody:
o krótki impuls (5-200μs) o wysokim napięciu (2-10 kV/cm), protoplasty i DNA zawieszone są w roztworze o soli o małym stężeniu;
o długi impuls (1-50 ms) o niższym napięciu (200-800 V/cm), roztwór soli o dużym stężeniu;
o połączenie elektroporacji z metodą chemiczną wykorzystującą glikol polietylenowy.
Mikrowstrzeliwanie,
zwane również mikrobombardowaniem lub metodą biobalistyczną. Wprowadzane DNA opłaszcza się na specjalnych mikronośnikach wykonanych z metali szlachetnych (tzn. złota lub wolframu). Pełnią one rolę pocisków, wstrzeliwanych do wnętrza komórki za pomocą tzw. strzelby genowej (ang. gene-gun, particle-gun, biobalistics, microprojectile bombardment). Prędkość takiego pocisku wynosi kilkaset m/s.
Efektywność tej metody jest stosunkowo niska i zależy od wielkości i rodzaju pocisku, podciśnienia panującego w komorze podczas strzału, typu zastosowanego aparatu, ciśnienia gazu napędzającego mikronośnik, dystansu, jaki musi on pokonać, aby dotrzeć do celu, formy plazmidu, a także od rodzaju transformowanej tkanki.
Wadą są stosunkowo wysokie koszta oraz ryzyko uszkodzeń konstrukcji genetycznej. Wysoka liczba wprowadzanych kopii transgenu zwiększa również prawdopodobieństwo wystąpienia błędów. Metoda ta jest jednak szeroko stosowana, gdyż można nią transformować praktycznie wszystkie rodzaje komórek.
Regeneracja roślin
Po wprowadzeniu do komórki pożądanego fragmentu DNA i wyselekcjonowaniu tych komórek które uległy transformacji, kolejnym krokiem jest regeneracja roślin w warunkach in vitro, czyli przekształcanie komórek w kompletne organizmy.
Wysoka kompetencja do transformacji nie jest jednoznaczna z wysoką kompetencją do regeneracji i odwrotnie. Bardzo często również, sprawdzone procedury regeneracji okazują się być nieskuteczne w przypadku komórek poddanych transformacji.
Regeneracja jest bardziej powtarzalna w przypadku zastosowania eksplantatów uzyskiwanych z kultur in vitro, które pozwalają uniknąć problemów związanych ze sterylizacją. Eksplantaty takie nie znajdują się również pod wpływem zewnętrznych bodźców sezonowych.
Wpływ na nie mają jedynie czynniki mogące być regulowane przez człowieka, takie jak etap rozwoju, wielkość prowadzonej kultury, czas trwania pasażu przed pobraniem eksplantatu i rodzaj stosowanej pożywki.
Kompetencje komórek do ulegania zarówno transformacji, jak i regeneracji można zwiększyć stosując tzw. prakultury na określonych pożywkach. Towarzyszący pobieraniu eksplantatu stres spowodowany uszkodzeniem tkanki i warunkujący powstawanie kalusa, nie nakłada się wtedy ze szkodliwym stresem wynikającym z prowadzenia kokultury z bakterią.
Czas kokultury powinien trwać na tyle długo, aby bakteryjny T-DNA mógł wniknąć do jak największej liczby komórek roślinnych. Nie może być on jednak zbyt długi, gdyż uniemożliwia to późniejsze wyeliminowanie bakterii. Ich obecność może ograniczać potencjał regeneracyjny powodować występowanie nekroz na roślinach. Aby pozbyć się bakterii, można płukać eksplantaty w roztworze antybiotyku lub też dodawać go do pożywki regeneracyjnej.
Skuteczne stężenie antybiotyku zwykle nie pozostaje jednak obojętne względem tkanek roślinnych. Przykładowo penicyliny stymulują wzrost kalusa i korzeni, a cefalosporyny ograniczają tworzenie się pędów i korzeni. Stężenie i rodzaj zastosowanego antybiotyku należy zatem wziąć pod uwagę podczas ustalania stężenia regulatorów wzrostu w pożywce. Ich ilość zależy między innymi od użytego szczepu bakterii, składu pożywki oraz wymagań eksplantatu.
Rozpoznanie i identyfikacja roślin transgenicznych
Rośliny transgeniczne rzadko różnią się wyglądem od swoich niezmodyfikowanych odpowiedników. Aby je rozróżnić należy wykonać testy na poziomie DNA lub dokonać analizy białek kodowanych przez wprowadzone sekwencje.
Metody oparte na detekcji DNA bazują najczęściej na łańcuchowej reakcji polimerazy (ang. ang. Polymerase Chain Reaction, PCR) powielającej specyficzne fragmenty genomu, które następnie poddaje się elektroforezie. Obecność lub brak prążka o określonej masie pozwala wykryć obecność badanej sekwencji. Amplifikacji powinny być poddane fragmenty, które są najbardziej charakterystyczne dla transgenu, nie występują w sposób naturalny lub nie uwidaczniają się w naturalnych warunkach reakcji PCR, a także mają małe szanse znalezienia się w sposób naturalny w roślinie, np. jako produkt infekcji bakteryjnej lub grzybowej. Elementami rozpoznania organizmów transgenicznych są głównie promotor, sekwencja kodująca, terminator oraz marker selekcyjny.
Efektywność tej metody zależy głównie od jakości i czystości badanego DNA. Pozwala ona na wykrycie zmian jedynie świeżym, to znaczy nieprzetworzonym np. niepoddanym obróbce termicznej, materiale roślinnym.
Ze względu na poziom specyficzności wyróżnia się kilka kategorii metod PCR stosowanych do analizy GMO. W każdej z nich powielany jest inny fragment DNA. Tak zwane metody screeningowe, polegające na detekcji elementów konstruktów najczęściej wykorzystywanych w transformacji, dostarczają jedynie wstępnych informacji dotyczących obecności lub braku modyfikacji genetycznej. Informacji o rodzaju dokonanych zmian dostarczają metody specyficzne względem genu, jednak na jednoznaczna identyfikację GMO pozwalają jedynie metody swoiste względem zdarzenie transformacyjnego.
Metody oparte na detekcji białek bazują na reakcjach immunologicznych pomiędzy przeciwciałem a specyficznym antygenem, np. test ELISA. Techniki te mogą być stosowane zarówno do oznaczeń jakościowych, jak i ilościowych. Nie są one jednak skuteczne w przypadku przetworzonego materiału rośłinnego.
Autor: Anna Kurcek
Literatura:
1. Buchowicz J., 2009. Biotechnologia molekularna. Modyfikacje genetyczne, postępy, problemy. Wydawnictwo Naukowe PWN. Warszawa.
2. Kozmana M., 2011, Złoty czas upraw GMO. RP.pl.
3. Ledakowicz S., 2011. Inżynieria biochemiczna. Wydawnictwo Naukowo-Techniczne. Warszawa.
4. Linkiewicz A., Iwona Wiśniewska I., Sowa S., 2006. Molekularne metody wykrywania i identyfikacji organizmów genetycznie zmodyfikowanych (GMO). Biotechnologia, 3 (74): 44–52.
5. Malepszy S., 2001. Biotechnologia roślin. Wydawnictwo Naukowe PWN, Warszawa Ratledge C., Kristiansen B., 2011. Podstawy biotechnologii. Wydawnictwo Naukowe PWN, Warszawa.
6. Ustawa o organizmach genetycznie zmodyfikowanych z dnia 22 czerwca 2001 r. (Dz. U. z dnia 25 lipca 2001 r.).
7. Informacje zawarte na stronie Komisji Europejskiej: http://ec.europa.eu
8. Informacje zawarte na stronie Międzynarodowego Instytutu Propagowania Upraw Biotechnologicznych (ISAAA): http://www.isaaa.org
9. Regestr GMO prowadzony w Ministerstwie Środowiska: http://gmo.mos.gov.pl/usage/register/index.php?site=main

